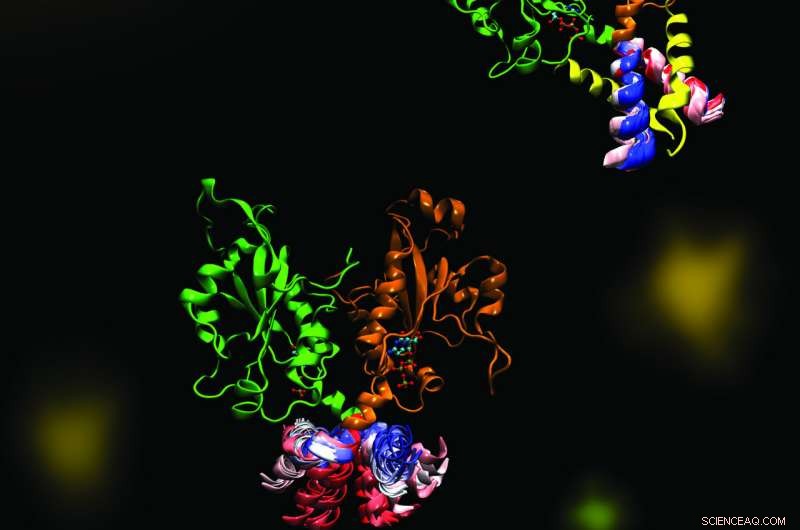
CCT är ett nyckelenzym som upprätthåller en balanserad sammansättning av cellmembranfosfolipider. Bilden belyser dynamiken hos en del av enzymet CCT som är avgörande för reglering av dess funktioner. Den molekylära dynamiken utforskades i ett samarbete mellan Cornell och Tielemans labb med hjälp av beräkningsmetoder. Kredit:Mohsen Ramezanpour och Jaeyong Lee
Den vanligaste molekylen i cellmembran är lipiden fosfatidylkolin (PC, allmänt känd som lecitin); följaktligen, enzymerna som är ansvariga för att syntetisera det är väsentliga. Forskning publicerad i 4 maj-numret av Journal of Biological Chemistry använde datorsimuleringar för att få insikter i hur ett av dessa enzymer aktiverar och stänger av PC-produktion. Dessa resultat kan hjälpa forskare att förstå varför små förändringar i detta enzym kan leda till tillstånd som blindhet och dvärgväxt.
Rosemary Cornell, en professor i molekylärbiologi och biokemi vid Simon Fraser University i Kanada, studerar enzymet CTP:fosfokolincytidylyltransferas, eller CCT. CCT anger hastigheten för PC-produktion i celler genom att binda till cellmembran med lågt PC-innehåll. När de är bundna till membran, CCT-enzymet ändrar form på ett sätt som gör att det kan utföra det nyckelhastighetsbegränsande steget i PC-syntesen. När mängden PC som utgör membranet ökar, CCT faller av membranet, och PC-produktionen upphör.
"Membranet är denna stora makromolekylära array med många olika molekyler i sig, ", sa Cornell. "Hur känner detta enzym igen att 'Åh, Jag borde sakta ner eftersom PC-innehållet i membranet blir för högt?'"
Cornell och hennes projektteam - ett samarbete med Peter Tieleman och doktorand, Mohsen Ramezanpour vid University of Calgary och Jaeyong Lee och Svetla Taneva, forskare vid SFU - tänkte att svaret måste ha att göra med de dynamiska formförändringar som enzymet genomgår när det binder till ett membran. Men dessa förändringar är svåra att fånga med traditionella strukturbiologiska metoder som röntgenkristallografi, som tar en statisk ögonblicksbild av molekyler. Istället, teamet använde beräkningssimuleringar av molekylär dynamik, som använder information om krafterna mellan varje enskild atom i en molekyl för att beräkna banorna för enzymets rörliga delar.
"Så det ser ut (när du visualiserar resultatet) är din stora molekyl som dansar framför dina ögon, ", sa Cornell. "Vi satte upp simuleringen av molekylär dynamik inte en enda gång, inte två gånger, men 40 olika (tider). Det tog månader och månader bara att göra beräkningsdelarna och ännu fler månader att försöka analysera data efteråt. Vi tillbringade faktiskt mycket tid när vi fick informationen och tittade på skärmen på dessa dansande molekyler."
Den simulerade dansen av CCT-molekylen visade att när M-domänen, den del av enzymet som vanligtvis binder till membranet, lossnar från ett membran, det fastnar den aktiva platsen för enzymet, hindrar den från att utföra sin reaktion. När det fasta segmentet togs bort från simuleringen, laget såg en dramatisk böjningsrörelse i dockningsplatsen för det fastnade elementet, och spekulerade att denna böjning skulle skapa ett bättre enzymaktivt ställe för att katalysera reaktionen när den fästes till ett membran. Teamet bekräftade dessa mekanismer med hjälp av biokemiska laboratorieexperiment.
Intressant, tidigare genetiska studier har visat att mutationer i genen som kodar för CCT är ansvariga för sällsynta tillstånd som spondylometafysdysplasi med konstavsdystrofi, som orsakar allvarliga störningar i bentillväxt och syn, men det var okänt hur dessa förändringar i enzymet kunde leda till så dramatiska konsekvenser. Cornell hoppas att förståelse för hur enzymet fungerar kan hjälpa forskare att ta reda på det.
"Om du bara har en liten förändring i CCT, hur kommer det då att göra hela processen med att syntetisera PC defekt?" frågar Cornell. "Det är vad vi studerar just nu."