
Elektronmikroskopi avslöjar närvaron av många sammankopplade vesiklar, som verkar bete sig som kollagenbärare (indikeras med pilar). Kreditera: Biokemiska och biofysiska forskningskommunikationer
Forskare vid Tokyo Institute of Technology (Tokyo Tech) har identifierat ett enzym som styr hur mycket kollagenceller som utsöndrar. Eftersom kollagenobalans är kopplad till en rad mänskliga sjukdomar, studien ger ledtrådar till nya terapeutiska strategier. Dessutom, fynden kan underlätta effektiv produktion av kollagen för maten, kosmetika- och läkemedelsindustrin.
Alla celler gör och frigör proteiner. Proteinerna är förpackade som "last" i små, bubbelliknande vesiklar innan de transporteras utanför cellen. Denna process, känd som sekret, är avgörande för sund tillväxt och utveckling.
Även om många studier har visat hur dessa vesiklar, kallas COPII-bärare, hantera relativt liten last, få har fokuserat på hur ovanligt stora bärare fungerar som är kända för att packa mycket stora proteiner, såsom kollagen.
Nu, en studie av forskare inklusive Masayuki Komada, Toshiaki Fukushima och doktorand Kohei Kawaguchi vid Tokyo Institute of Technology har identifierat USP8 som ett nyckelenzym involverat i att kontrollera bildandet av stora kollagenbärare. De har rapporterat sina fynd i tidskriften Biokemiska och biofysiska forskningskommunikationer .
Teamet visade att "att slå på" USP8 hämmade bildandet av stora bärare, och därmed minskad kollagenutsöndring. Omvänt, stänga av USP8 främjade kollagentransport, vilket ledde till ökad kollagenutsöndring. (Se bild 1-3.)
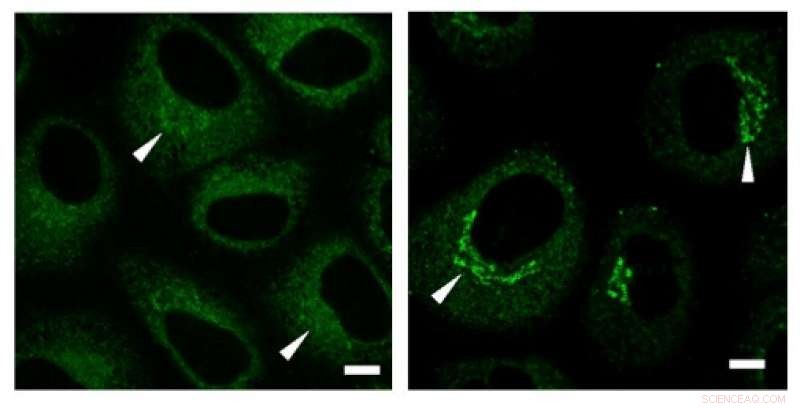
Immunfärgningsexperiment avslöjade en hög koncentration av kollagen (gröna signaler) i Golgi-regionen före utsöndring. Kreditera: Biokemiska och biofysiska forskningskommunikationer
Fynden har stora konsekvenser för medicin och bioteknik. Överdriven kollagenutsöndring i människokroppen är känd för att orsaka organfibros, medan för lite kollagenutsöndring är associerad med bensjukdomar inklusive kranio-lenticulo-sutural dysplasi (CLSD) och Cole-Carpenters syndrom. Nya behandlingar för dessa sjukdomar skulle kunna utvecklas genom ytterligare förståelse av USP8:s exakta verkningssätt. Sådan kunskap skulle också kunna ge nya sätt att skala upp kommersiell produktion av kollagen.
Forskarna har visat att enzymet fungerar genom att deubiquitinera ett protein som heter Sec31A, en komponent av COPII-vesikelhöljet som krävs för proteinexport.
En särskild grupp av proteiner som kallas USP8-STAM1-komplexet verkar vara ansvarig för deubiquitinating Sec31A, som illustreras i figur 3.
Studien bygger på många års forskning som har belyst mångsidigheten hos USP8.
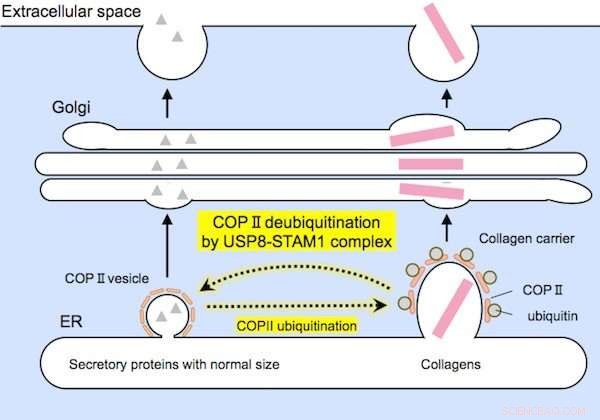
Relativt små proteiner (till vänster) och stora kollagener (till höger) är inkapslade av COPII-bärare av lämplig storlek före utsöndring. USP8-STAM1-komplexet hämmar bildningen av stora kollagenbärare. Kreditera: Biokemiska och biofysiska forskningskommunikationer
"Vi hade tidigare rapporterat att USP8 reglerar hypofyshormonutsöndring, " säger Fukushima, hänvisar till en tidning publicerad i Naturgenetik 2015. "I processen med den studien, vi upptäckte av misstag att USP8-STAM1-komplexet binder till Sec31."
Det var detta "oavsiktliga" fynd, i kombination med lovande resultat från andra grupper i USA, som ledde till att teamet undersökte USP8:s roll i bildandet av COPII-bärare.
I forskning som går tillbaka mer än ett decennium, Komada och andra har klargjort den konventionella rollen för USP8 i regleringen av endocytos5. "Det är väldigt intressant att samma USP8-STAM1-komplex nu har visat sig spela en viktig roll både i regleringen av endocytos och i sekretion, " säger Fukushima.
Den aktuella studien avslöjar därför ett "nytt ansikte" för USP8-enzymet, och Fukushima tipsar om att det kan komma fler överraskningar. USP8 tillhör en familj av cirka 90 kända deubiquitinating enzymer, som fortsätter att vara ett hett ämne inom cellbiologi.