Under elektrolys av vatten, elektricitet förs genom vattnet för att dela upp det i andra ämnen. I den önskade reaktionen, flytande vatten (H2O) delas upp i syrgas (O2) och vätgas (H2). I saltvatten, natriumklorid (NaCl) är närvarande som lösta natrium- och klorjoner (Na + och Cl - ). I detta fall, en andra reaktion kan också inträffa under elektrolysen, där klorjonerna omvandlas till klorgas (Cl 2 ). Kredit:Leiden University
Forskargruppen som leds av Leiden -kemisten Marc Koper har upptäckt en katalysator som minimerar produktionen av klorgas under saltvattenelektrolys. Uppfinningen kan möjliggöra direkt produktion av väte från havsvatten. Artikeln har publicerats i Journal of the American Chemical Society .
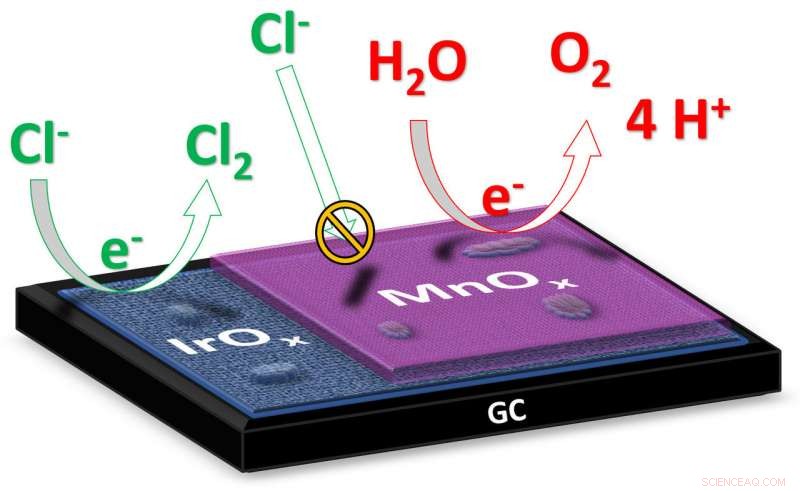
"Vid elektrolys av saltvatten, som havsvatten, det slutliga målet är att producera väte vid katoden, "förklarar doktoranden Jan Vos från Leiden Institute of Chemistry." Produkten som bildas vid anoden är idealiskt syre, eftersom det är ofarligt för miljön. "Men vid saltvattenelektrolys kan också giftig klorgas bildas vid anoden. Forskarna har nu tagit fram en katalysator som minimerar bildandet av klorgas till förmån för syrebildning. Vos förklarar:"Katalysatorn består av två metalloxider:iridiumoxid med ett lager manganoxid bara ett dussin nanometer tjockt. Iridium är ett material som uppvisar hög katalytisk aktivitet för bildandet av både syrgas och klorgas; manganoxiden verkar som ett slags membran som förhindrar tillförsel av kloridjoner och undertrycker bildandet av klorgas. "
Elektrolys av vatten är ett viktigt steg för produktion och användning av väte som en alternativ energibärare. En anod som motverkar bildandet av klorgas möjliggör vattenelektrolys där det inte är nödvändigt att först avlägsna vattnet från upplöst salt, vars process fortfarande kostar betydande mängder energi och kapital. Det skulle möjliggöra direkt produktion av väte från havsvatten, och därmed lindra de sällsynta sötvattenreserverna på jorden.
Enligt Vos, en användbar bieffekt av saltvattenelektrolys är produktionen av mycket rent sötvatten. "Om den extraherade vätgasen slutligen används som bränsle, till exempel i en bils bränslecell, vätet reagerar tillbaka till vatten med syrgas från atmosfären. På det sättet, den storskaliga tillämpningen av vattenelektrolys och väte i bränsleceller kommer att leda till stora mängder av denna "avfallsprodukt":rent vatten. I en framtid där vattenbrist blir ett allt mer akut problem, detta skulle absolut inte vara oönskat. "
Forskningen belyser en fråga inom kemi som har pågått i årtionden. "Vi hade ursprungligen ingen aning om varför material baserade på manganoxid hade så hög selektivitet mot syre. Vi antog att det var enbart en katalytisk egenskap hos materialet, men möjliga effekter av diffusionsbarriärer:den selektiva blockeringen av transporten av kloridjoner ... Det kom inte ens att tänka på! Faktiskt, det är väldigt grundläggande, effektiv lösning på ett mycket komplext problem. Det har radikalt förändrat vår forskningsriktning. "
Upptäckten har konsekvenser för selektivitet vid elektrolys. Selektivitet är ett viktigt kriterium för hur väl en katalysator fungerar. I många (elektro-) kemiska processer, det är möjligt att bilda olika produkter under en reaktion, men man hoppas att endast den erforderliga produkten bildas. Sättet att påverka selektiviteten är vanligtvis att välja katalysatorn mycket exakt och finjustera den, men det tar mycket tid och pengar. Dessutom, det är inte alltid möjligt att kombinera hög selektivitet med hög aktivitet, en annan viktig egenskap.
Enligt Vos, forskningen passar fint in i en framväxande, alternativ trend inom elektrokatalys:användning av vissa beläggningar för att förbättra en katalysator. "Ett sådant lager förhindrar att oönskade reaktanter når katalysatorn. Detta gör att ett aktivt men icke-selektivt katalytiskt material kan göras selektivt på ett alternativt sätt."