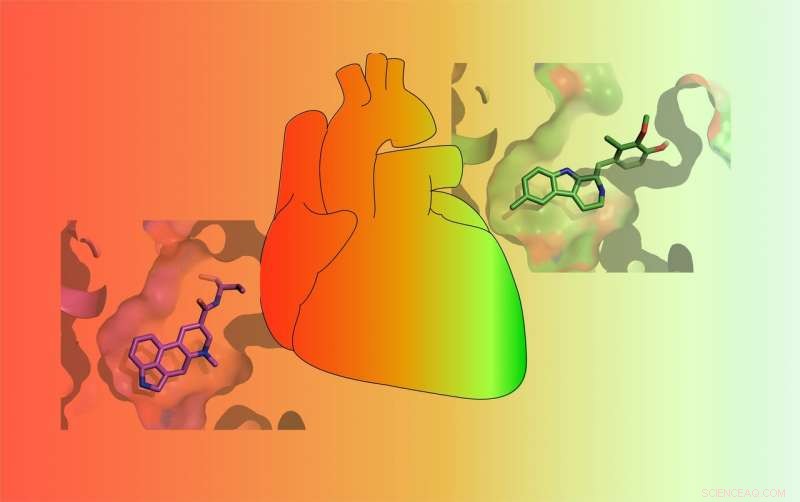
Läkemedel varierar i sin förmåga att aktivera 5-HT2B-serotoninreceptorn. Vissa läkemedel (RÖD) aktiverar receptorn starkt och orsakar potentiellt livshotande hjärtklaffsjukdom medan andra endast svagt aktiverar den (GRÖN) och är mindre benägna att orsaka allvarliga biverkningar. Kredit:Roth Lab
Serotonin, känd som "lycka"-neurotransmittorn, är en kemikalie som finns i kroppen och ansvarar för känslor av välbefinnande. Men serotonin är inte den enda kemikalien som binder till de 13 serotoninreceptorerna som finns på cellytan. Långt ifrån. Många godkända läkemedel binder även till serotoninreceptorer. Och en av dessa receptorer-kallad 5-HT2BR-har gjort läkemedelsutvecklare mycket olyckliga. Det beror på att vissa läkemedel som behandlar Parkinsons sjukdom, migrän, hypofys tumörer, och fetma utformades för att rikta in sig på andra cellulära receptorer men också aktivera 5-HT2BR, leder till livshotande hjärtklaffsjukdom. Som ett resultat, många av dessa droger har tagits från marknaden.
Nu, för första gången, UNC School of Medicine forskare har kommit på exakt varför ett läkemedel binder till 5-HT2BR och aktiverar receptorn för att orsaka hjärtproblem medan mycket liknande läkemedel inte gör det. De har också upptäckt varför en tredje drog fungerar som en 5-HT2BR-antagonist – den blockerar receptorns aktivitet – medan den mycket välkända liknande hallucinogena drogen LSD inte gör det.
Publicerad i Naturens strukturella och molekylära biologi , denna forskning ger läkemedelsutvecklare välbehövlig insikt i denna serotoninreceptor och andra liknande.
"Under en lång tid, vi har behövt veta exakt hur denna receptor och andra binder till olika föreningar om vi vill designa säkrare och effektivare mediciner, " sa seniorförfattaren Bryan L. Roth, MD, Ph.D., Michael Hooker Distinguished Professor of Protein Therapeutics and Translational Proteomics vid Institutionen för farmakologi. "Att lösa kristallstrukturerna för dessa serotoninreceptorer bundna till flera föreningar är det viktiga första steget som behövs för att skapa bättre mediciner, inte bara för de ovannämnda tillstånden utan för många andra inklusive schizofreni, ångest, och depression."
I experiment som leds av John McCorvy, Ph.D., som var en postdoktor i Roth -labbet under denna forskning, forskare inducerade mödosamt receptorerna att kondensera till ett tätt packat kristallgitter medan receptorerna fästes vid ett läkemedel. Sedan sköt de röntgenstrålar mot kristallen för att beräkna receptorns struktur från de resulterande diffraktionsmönstren. McCorvy och kollegor gjorde detta flera gånger för att kristallisera serotoninreceptorer bundna till flera olika föreningar, vilket hade varit omöjligt i årtionden eftersom receptorer är notoriskt ombytliga proteiner - små, ömtålig, och vanligtvis i rörelse när de binder till föreningar.
Forskarna använde sedan andra experimentella tekniker som beskrivs i artikeln för att visa exakt hur varje läkemedel antingen aktiverade eller inte aktiverade receptorn.
I en uppsättning experiment, McCorvy och kollegor visade att metylergonovin - den aktiva ingrediensen i en migränmedicin - binder till en viss region av 5-HT2BR och aktiverar den. Metylergonovin är en agonist. Men dess moderförening, metysergid, aktiverar inte receptorn, gör den till en antagonist. Roths labb upptäckte att skillnaden mellan de två läkemedlen är bara en kolatom och några väteatomer. Tillsammans kallas de en metyl. Denna lilla metyl visar sig vara boven i hjärtklaffproblem relaterade till 5-HT2BR.
I en andra uppsättning experiment, de visade varför Parkinsonsläkemedlet lisurid inte aktiverar 5-HT2BR men LSD gör det. Skillnaden vid bindningsstället är bara en enda kväveatom och stereokemi - i huvudsak utrymmet mellan läkemedlet och receptorn som spelar en roll i hur exakt vilket läkemedel som helst kan passa in i receptorn för att trigga eller stoppa cellulär aktivitet.
Intressant, lisurid och LSD binder till serotoninreceptorn i den typiska region som forskare förväntar sig. Men kemin av hur dessa två droger binder på den platsen förklarar inte deras mycket olika effekter på celler och människor. McCorvy och kollegor fann att lisurid också kilas in i en annan del av receptorn som kallas den utökade bindningsfickan, men lisurides kontakt är inte stark. LSD å andra sidan binder starkt vid den förlängda bindningsfickan, gör LSD till en mycket stark agonist – det aktiverar 5-HT2BR (liksom andra receptorer). LSD gör det genom att rekrytera ett protein som kallas beta-arrestin2. Forskare kallar denna process "aktivering av β-arrestinvägen, " och det har varit inblandat i olika biverkningar relaterade till terapi.
Dessa fynd kommer att hjälpa läkemedelsdesigners att undvika att aktivera 5-HT2BR när de designar mediciner för att rikta in sig på andra receptorproteiner - vanligtvis hänvisade till en G-proteinkopplad receptor, eller GPCR. Omvänt, denna forskning kommer att hjälpa läkemedelsutvecklare som vill hämma aktiveringen av 5-HT2BR för att behandla hjärtklaffsjukdomar och andra störningar.
"I grund och botten, genom att kristallisera strukturerna av 5-HT2BR bundet till flera vanliga läkemedel, vi fann att det inte finns någon mekanism genom vilken receptorn aktiveras, " sa McCorvy. "Det finns flera." För att skapa en exakt, säker, och effektiv medicinering, forskare vill bara utnyttja de cellulära vägar som är viktiga för att behandla tillståndet de är intresserade av. McCorvy tillade, "Det är i framkant av läkemedelsutvecklingen."