Omslagsbild av den aktuella upplagan av Green Chemistry med HIMS/Biocat -forskningen.
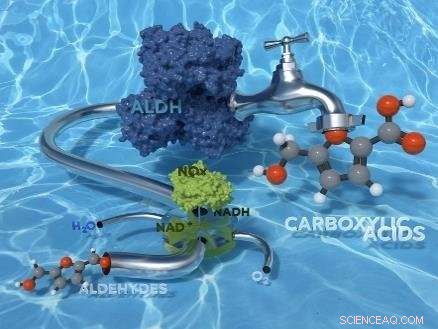
Forskare från University of Amsterdams Van't Hoff Institute for Molecular Sciences (HIMS) har utvecklat den första livskraftiga biokatalytiska "gröna" processen för kemoselektiv oxidation av aldehyder till karboxylsyror. Papperet som beskriver forskningen finns i den aktuella upplagan av tidskriften Grön kemi .
Oxidationen av aldehyder till karboxylsyror är en viktig och industriellt relevant kemisk reaktion, till exempel med avseende på syntesen av läkemedel och biobaserade polymerer. Nuvarande förfaranden för oxidation kräver riklig användning av giftiga kemiska reagens och ger ofta oönskade biprodukter.
På jakt efter förbättring av miljöavtrycket för aldehydoxidation, olika nya syntetiska metoder har undersökts. Tills nu, dock, inget ekonomiskt genomförbart förfarande har utvecklats som är baserat på miljömässigt godartade reagenser och/eller lösningsmedel, och som kombinerar en förhöjd produktivitet med en perfekt selektivitet (vilket innebär att endast önskade aldehydfunktionella grupper oxideras, på så sätt minimerar eller till och med helt undviker bildandet av oönskade sidoprodukter).
Godartad biokatalys
Som ett intressant "grönt" alternativ, biokatalytisk, enzymbaserade metoder för oxidation av funktionella grupper uppvisar milda reaktionsförhållanden (omgivningstemperatur och atmosfärstryck) i en vattenhaltig miljö, och de uppnår i allmänhet mycket bra selektiviteter. Vidare, de kan använda molekylärt syre som en godartad oxidant.
HIMS -forskargruppen som leds av DrFrancesco Mutti har nu framgångsrikt undersökt användningen av aldehyddehydrogenasenzymer för oxidation av aldehyder till karboxylsyror. I en artikel som nyligen accepterats av RSC-tidskriften med hög effekt Grön kemi , forskarna presenterar en studie om tre rekombinanta aldehyddehydrogenaser härrörande från nötkreaturlinser och bakterierna Escherichia coli och Pseudomonas putida. För regenerering av det katalytiska NAD+ koenzymet, de tillämpade H 2 O som bildar NAD-oxidas från Streptococcus mutans. Den slutliga biooxidationen löper i vattenhaltig fosfatbuffert, under milda reaktionsförhållanden (40 ° C och atmosfärstryck) och förbrukar endast dioxyr från luften som oxidationsmedel.
Omfattande studie
För att undersöka potentialen hos de tre enzymerna, forskarna utförde en omfattande studie där de testade sextio-en strukturellt olika aldehyder. Majoriteten av dessa substrat (alifatiska, aryl alifatisk, bensyl-, hetero-aromatiska och bicykliska aldehyder) omvandlades med utbyten på väl över 60% och i många fall till och med över 99%. De enda undantagen var några ortsubstituerade bensaldehyder och två bicykliska heteroaromatiska aldehyder.
I samtliga fall, kemoselektiviteten var perfekt:ingen annan produkt detekterades förutom den förväntade karboxylsyran. Detta innebär att andra oxiderbara funktioner (såsom hydroxyldelen, alkengrupper, arylgrupper, och svavel samt kväve -heteroatomer) förblev orörda.
Hela celler
Eftersom för praktiska tillämpningar är användning av hela celler snarare än renade enzymer att föredra, undvika tidskrävande och kostsamma reningssteg, forskarna undersökte också biooxidationen med E. coli frystorkade hela celler såväl som vilande celler. Det visade sig att tillskott av NAD+koenzym och NOx -återvinningsenzym kan utelämnas i vissa fall eftersom den mikrobiella värden producerar tillräcklig mängd koenzym, som kan återvinnas av endogena E. coli -enzymer.
Forskarna drar slutsatsen att aldehyddehydrogenaser har potential att bli förstahandsvalet för kemoselektiv oxidation av aldehyder till karboxylgrupper. Deras biokatalytiska metod är särskilt attraktiv för oxidation av aldehydgrupper inom molekyler som har ytterligare oxiderbara grupper. Framtida forskning kommer att fokusera på att förbättra enzymernas tolerans mot substratkoncentration och långsiktig stabilitet för att möjliggöra ännu bredare tillämpning av dessa enzymer.