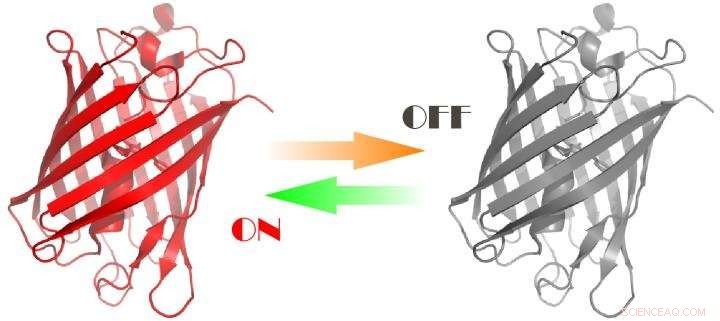
3D -modell av det utvecklade proteinet Kredit:Aleksandr Mishin
Forskare har utvecklat fluorescerande proteiner som kan styras av orange och grönt ljus. Dessa proteiner hjälper till att studera processer i levande celler. Resultaten publicerades i Naturmetoder .
Fluorescerande proteiner avger intensivt synligt ljus med våglängder från 390 till 700 nm. Naturliga funktioner hos sådana proteiner är olika; till exempel, vissa maneter använder gröna fluorescerande fläckar för att locka till sig små organismer som fungerar som föda. Optiska egenskaper hos vissa fluorescerande proteiner kan kontrolleras med ljus. Till exempel, sådana proteiner kan aktiveras och avaktiveras, och kallas därför växlingsbara. Växlingsbara fluorescerande proteiner används i stor utsträckning i en ny grupp metoder som kallas superupplöst fluorescensmikroskopi (nanoskopi), vilket möjliggör avbildning av extremt detaljerade intracellulära strukturer. För närvarande, forskare brukar använda blå eller violett bestrålning för sådan mikroskopi, vilket är mycket giftigt för celler eftersom det stör deras normala fysiologi och kan till och med orsaka död.
"Vi var de första som skapade fotoswitchbara fluorescerande proteiner med optiska egenskaper som kan kontrolleras med grönt och orange ljus snarare än blåviolett strålning. Fördelen med detta är minimal skada på celler. Vi använde nya proteiner för att observera förändringar av cytoskelet i levande celler över tid, "förklarade Aleksandr Mishin, Ph.D, senior forskare vid Shemyakin-Ovchinnikov Institute of Bioorganic Chemistry vid Ryska vetenskapsakademien, som ledde RSF -projektet.
För att skapa sådana fluorescerande proteiner, forskarna ändrade dem genom riktad och slumpmässig mutagenes via polymeraskedjereaktion. Sedan klonade forskarna proteiner och valde de bäst presterande med hjälp av ett mikroskop. Författarna analyserade resultaten av experiment som utförts av andra biologer och bestämde hur mikromiljön i kromoforen (den aromatiska aminosyraresten som är ansvarig för ljusabsorption i proteinet) måste ändras för att göra den i stånd att fotografera.
Dock, det förväntade resultatet har biverkningar, inklusive minskad ljusstyrka hos proteinet. Forskarna använde slumpmässig mutagenes för att hitta ytterligare mutationer, som kompenserar för metodens biverkningar samtidigt som målmutationen bevaras.
Proteinerna kallas reporterproteiner, eftersom de fungerar som "spioner" i cellerna. De är fästa vid andra proteiner som sedan kan spåras i en levande cell. Den detaljerade information som erhålls därigenom kan användas inom grundvetenskap eller biomedicinsk forskning. Till exempel, tumörceller hos cancerpatienter uppvisar dramatiska störningar av cellmobilitet och dynamiska strukturförändringar i cytoskelet, en slaktkropp i cytoplasman i en levande cell. Under tiden, undersökningen av dessa processer i levande celler genom nanoskopi är svår på grund av alltför intensiv bestrålning av prover, gör det nödvändigt att använda metoder som är mindre giftiga för organismen.
Författarna använde sin utveckling för att utföra RESOLFT superupplöst mikroskopi. Proteinerna har en viktig egenskap:Deras fotoswitching är mycket effektiv, vilket innebär att fluorescens kan slås på och av på millisekunder. Detta passar inte alla mikroskopimetoder. I vissa fall, den höga hastigheten kommer bara att vara till besvär. I RESOLFT, på-av-cykeln upprepas många gånger för närliggande punkter som skannas med laserstrålar. Ju bättre omkopplingstiden för en fluorescerande tagg, ju snabbare hela bilden kan erhållas, eftersom fotoswitching vid varje punkt kräver mindre tid.
"De fluorescerande proteinerna vi skapade möjliggör superupplösande mikroskopi utan att skada den levande cellen, som öppnar möjligheter för att studera dynamiska processer inom cellen, "Avslutade Aleksandr Mishin.