Upphovsman:University of North Carolina vid Chapel Hill School of Medicine
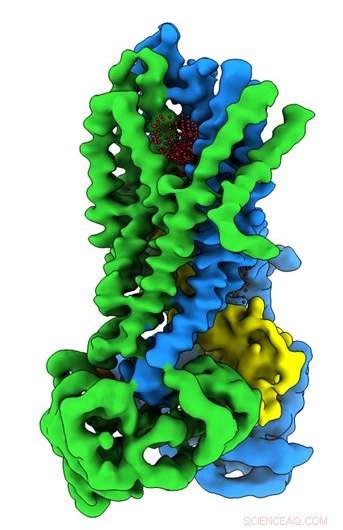
Forskare vid UNC School of Medicine i samarbete med forskare vid Oregon Health &Science University har löst den tredimensionella molekylstrukturen hos proteinet som är defekt hos personer med cystisk fibros i proteinets aktiva och inaktiva tillstånd. Upptäckten, publicerad i tidningen Biokemi , kan öppna nya forskningsvägar och hjälpa läkemedelsutvecklare att skapa förbättrade farmakoterapier för att hjälpa personer med CF.
Mycket av det biokemiska arbetet gjordes i laboratoriet av John Riordan, Doktorsexamen, framstående professor i biokemi och biofysik vid UNC-Chapel Hill. I slutet av 1980 -talet Riordans laboratorium upptäckte den muterade genen som är ansvarig för CF. Om ett barn får en kopia av denna defekta gen från varje förälder, barnet kommer att utveckla CF. Proteinet som kodas av denna gen kallades cystisk fibros transmembranregulator, eller CFTR, som är kloridkanalen i epitelceller som fyller andningsorganen. Personer med CF saknar en funktionell epitelkloridkanal, vilket är viktigt för att upprätthålla en korrekt balans mellan salt och vatten i lungor och andra organ. Ett resultat av detta är produktionen av tjocka, klibbigt slem som blir svårt att röra sig ur luftvägarna, vilket leder till kroniska infektioner och en kortare livslängd för de flesta med CF.
I Riordan -labbet, postdoktor Jonathan Fay, Doktorsexamen, ledde experiment med enpartikelkryo-elektronmikroskopi för att upptäcka molekylstrukturen för CFTR i närvaro av ATP-en komplex organisk kemikalie som är nödvändig för många processer i celler, inklusive en fungerande kloridjonkanal som är avgörande för korrekt lungfunktion. För att fånga upp strukturer av CFTR -proteinet i dess aktiva och inaktiva tillstånd, Riordan-labbet stabiliserade CFTR-proteinet så att kanalen var avstängd när den defosforylerades och låstes när den fosforylerades.
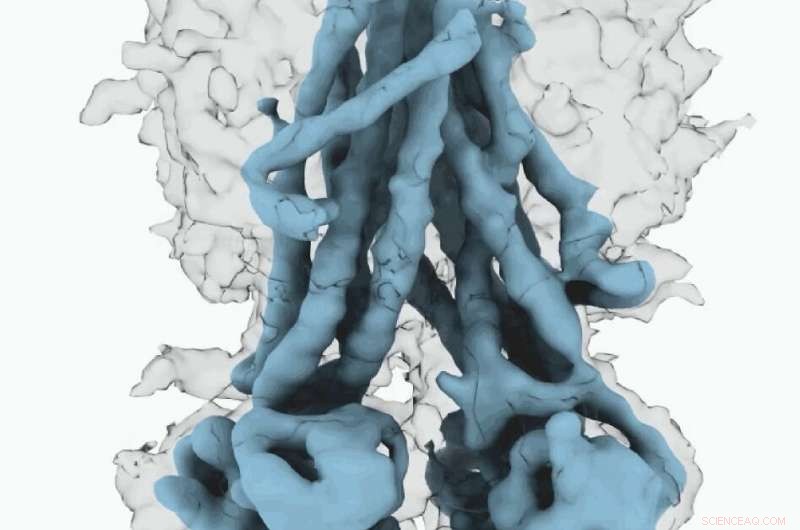
Cryo-EM-karta över CFTR. Upphovsman:University of North Carolina vid Chapel Hill School of Medicine
Dessa molekylära strukturer avslöjar en unik omplacering av delar av CFTR -proteinet, ge insikter i den strukturella övergången mellan aktiva och inaktiva funktionella tillstånd för CFTR.
Dessutom, Fay och kollegor observerade detaljer om detta proteinkomplex som skiljer sig från vad andra forskare har upptäckt i tidigare CFTR -strukturer.
"Det är verkligen häpnadsväckande hur mycket cryo-EM-teknik som har avancerat och hur man kan använda dessa tekniker för att visualisera olika tillstånd i kanalen, "Fay sa." Jag tycker att våra resultat är mycket spännande. Vi upptäckte en ny portal som presenterar ett lovande nytt område av kanalen för att rikta in och styra CFTR -kanalfunktionen. "
Och om forskare framgångsrikt kan rikta in sig på och kontrollera kanalens funktion, då kunde de skapa mer exakta behandlingar för att bättre behandla vissa personer med CF.