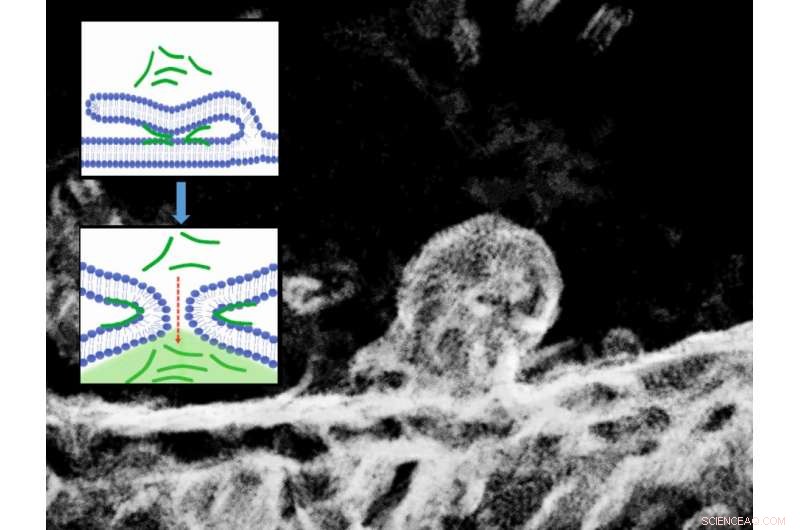
Elektronmikroskopibild av ett förgrenat cellmembran och motsvarande molekylära schema för processen. Kredit:@ IOCB Prag
Den enkla transporten av läkemedel direkt in i cellerna är ett av de primära målen för läkemedelsindustrin. Till stor del, forskare har fortfarande inte en detaljerad förståelse på molekylär nivå av de processer som är ansvariga för att transportera ämnen in i och ut ur celler. I samarbete med kollegor från Tjeckien och Tyskland, forskargruppen Pavel Jungwirth från Institutet för organisk kemi och biokemi vid Tjeckiska vetenskapsakademin (IOCB Prag) har upptäckt en tidigare okänd mekanism genom vilken korta peptider kan penetrera celler och i princip, skulle kunna fungera som bärare av läkemedelsmolekyler. Resultaten av deras forskning har nu publicerats i Proceedings of the National Academy of Sciences .
Förmågan hos positivt laddade korta peptider att penetrera celler observerades först i HIV-forskning, och idag, det används gradvis för att transportera droger in i celler. Tills nu, dock, detta tog främst formen av så kallad vesikulär transport, dvs. med hjälp av en transportvesikel som separerar från cellmembranet och omsluter det transporterade ämnet, som sedan måste bryta sig loss från vesikeln efter att transporten in i cellen är klar, potentiellt utgöra en teknisk komplikation för effektiv transport av läkemedlet. Det är känt att peptider också kan penetrera celler passivt, dvs oberoende av energi från cellen, men den exakta mekanismen har ännu inte beskrivits.
Nu, använda fluorescens och elektronmikroskopi i kombination med molekylära datorsimuleringar, forskarna har upptäckt en tidigare obeskriven passiv mekanism för att transportera positivt laddade peptider in i celler. Den är baserad på membranfusion inducerad av de transporterade peptiderna (se bilden). Forskarna har sålunda visat att processen med passiv transport av peptider in i celler och den allmänt kända processen med membranfusion — till exempel, som induceras av kalciumjoner i neuroner under överföringen av nervimpulser - delar samma mekanistiska grund. Bildligt talat, de är två sidor av samma mynt.
"Vid denna punkt, vi kan bara spekulera i praktiska tillämpningar för upptäckten, " säger Jungwirth. "Om, dock, denna nyupptäckta mekanism visar sig vara tillräckligt robust, i framtiden, vi skulle kunna överväga möjligheten att passivt transportera läkemedelsmolekyler in i celler utan att behöva befria dem från vesikler, som, i denna process, bildas helt enkelt inte."
Jungwirth och hans team har länge fokuserat på att avslöja lagarna som styr molekylära processer i cellmembranet, som, till denna dag, är fortfarande i stort sett okända. En bättre förståelse för de grundläggande processerna som sker inom cellmembranen öppnar gradvis dörren till nya möjligheter att kontrollera dessa processer och därigenom tänkbara effektivare metoder för att transportera läkemedelsmolekyler till deras verkningsställe.