
En demonstration av molekylär kiralitet med hjälp av 3D-atommodeller i labbet. Kredit:J. Waser/EPFL
Många kemiska molekyler kan existera i naturen tillsammans med sina spegelmotsvarigheter; som händer, två föreningar kan vara uppbyggda av samma atomer i samma övergripande struktur men i motsatta riktningar, dvs vänsterhänt och högerhänt. Detta symmetrifenomen kallas "kiralitet", och kan ge spegelmotsvarigheter ("enantiomerer") helt andra kemiska egenskaper. Ett känt och tragiskt exempel på kiralitet är talidomid, som ursprungligen såldes som en blandning av båda enantiomererna. Problemet var att det ena var ett ofarligt lugnande medel och det andra mycket giftigt för foster, vilket resulterar i störande medfödda missbildningar.
Så idag har det blivit absolut nödvändigt att syntetisera föreningar med vad som kallas hög "optisk renhet", vilket är ett mått på kiral renhet:graden till vilken ett prov innehåller en enantiomer i större mängder än den andra. Men eftersom enantiomerer har mycket små strukturella skillnader och identisk stabilitet, att syntetisera den ena över den andra är en mycket utmanande uppgift.
Ett sätt att göra detta är vad kemister kallar "desymmetrisering" av en icke-kiral förening som liknar målmolekylen. Detta innebär att modifiera en molekyl så att den förlorar de symmetrielement som hindrade den från att vara kiral.
Forskare vid Jérôme Wasers Laboratory of Catalysis and Organic Synthesis vid EPFL har nu utvecklat en ny desymmetriseringsstrategi för att komma åt kirala byggstenar som innehåller ureasubstrukturer. Ureaderivat är viktiga komponenter i biomolekyler som biotin (vitamin B7) eller bioaktiva naturprodukter, såsom anticancer-agelastatin A.
Forskarna gjorde två avgörande innovationer. Först, de designade en icke-kiral cyklopropan (tre-ledad kolring) prekursor. Denna molekyl erbjuder förbättrad reaktivitet och är idealisk för reaktioner under milda förhållanden.
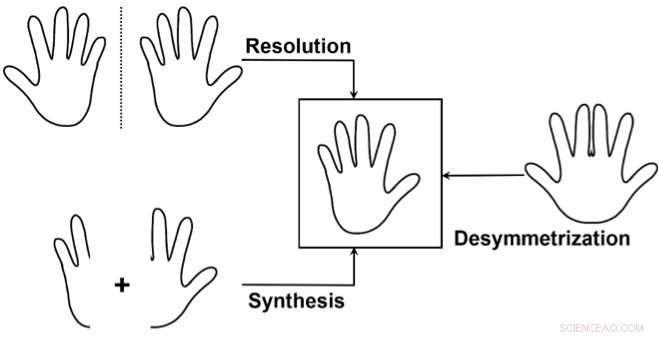
De tre huvudsakliga metoderna för att selektivt få tillgång till en enantiomer:1) Separera en blandning av de två enantiomererna (upplösning), slösar bort en av enantiomererna. 2) Syntetisera selektivt endast en av de två enantiomererna. 3) Använd en "desymmetrisering" av en icke-kiral förening som liknar målet. Detta används mindre ofta, men det är särskilt elegant eftersom det kan avslöja chiralitet från en redan relativt komplex föregångare genom att bryta symmetrin i endast en enkel transformation. Kredit:J. Waser/EPFL
Andra, forskarna konstruerade en ny kopparkatalysator som kan bilda en enantiomer av den önskade produkten med hög selektivitet. Kopparcentret binder och aktiverar cyklopropanprekursorn, får dess band att brytas. Prekursorn attackeras sedan av en indol, en molekyl som är mycket viktig som strukturelement i bioaktiva föreningar. Som ett resultat, prekursorn förlorar sin symmetri - och blir därför kiral - och kan användas för att selektivt göra den önskade enantiomeren.
Arbetet är ett viktigt genombrott, eftersom desymmetriisering aldrig har använts för att komma åt kirala urea från cyklopropaner tidigare. "Nya byggstenar kan nu lätt nås som rena enantiomerer, och kan testas för bioaktivitet eller användas för att syntetisera mer komplexa kirala molekyler, " säger Jérôme Waser. "Dessutom, den nya katalysatorn vi har designat kommer säkerligen att vara användbar för andra tillämpningar inom syntetisk kemi."
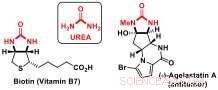
Karbamider:viktiga byggstenar för bioaktiva molekyler. Kredit:J. Waser/EPFL