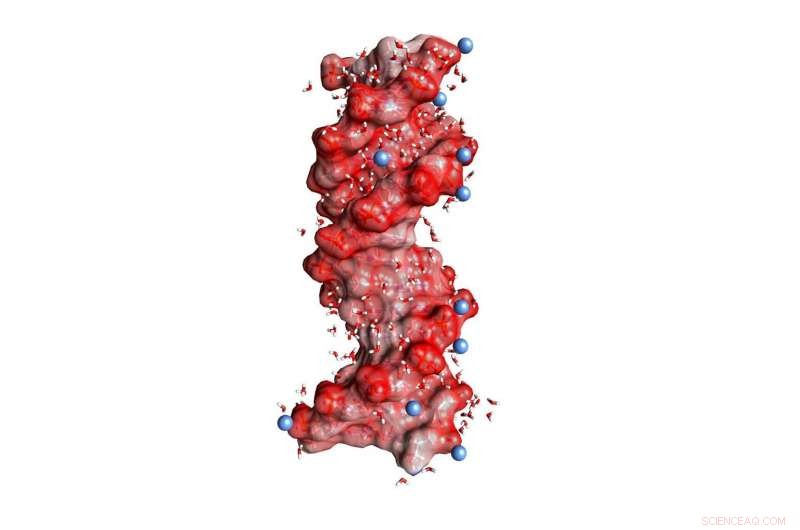
Fig. 1:DNA dubbelhelix inbäddad i vatten (vinklade små molekyler, Ej skalenlig). De mörkröda sfärerna på helixytan representerar syreatomer i de negativt laddade PO2-enheterna, de blå sfärerna positivt laddade joner i miljön. Upphovsman:MBI Berlin
Par av negativt laddade fosfatgrupper och positiva magnesiumjoner representerar en viktig strukturell egenskap hos DNA och RNA inbäddat i vatten. Vibrationer av fosfatgrupper har nu etablerats som selektiva sonder för sådana kontaktpar och möjliggör en kartläggning av interaktioner och struktur på de ultrasnabba tidsskalorna för molekylär dynamik.
DNA och RNA är laddade polymerer som kodar för genetisk information i en dubbelhelixstruktur och fungerar som nyckelspelare i biosyntesen av proteiner. Deras negativa laddningar är belägna i den molekylära ryggraden, som består av joniskt fosfat (PO 2- ) och av sockergrupper (Figur 1). Stabilisering av de makromolekylära strukturerna av DNA och RNA kräver en kompensation av starka frånstötande elektriska krafter mellan de lika laddade fosfatgrupperna med joner av motsatta, dvs. Positiv laddning. I detta sammanhang, magnesium (Mg 2+ ) joner är särskilt relevanta eftersom de inte bara stabiliserar strukturen utan också förmedlar erkännande av externa bindande partner och fungerar som katalytiska centra. Dessutom, förändringar av makromolekylär struktur via dynamiska vikningsprocesser är kopplade till en omarrangering av positiva joner inbäddade i det omgivande vattenskalet.
Positiva joner är ordnade i olika geometrier runt DNA och RNA:i så kallade platsbundna eller kontaktpargeometrier, en positiv jon är belägen i direkt kontakt med en syreatom i en fosfatgrupp. I kontrast, den så kallade yttre jonatmosfären består av positiva joner separerade av minst ett lager av vattenmolekyler från fosfatgrupperna. De olika geometriernas funktionella roll och de underliggande interaktionerna är långt ifrån förstådda. En djupare insikt på molekylär nivå kräver mycket känsliga sonder som gör det möjligt att urskilja de olika jongeometrier utan att störa dem, och för att kartlägga deras dynamik på den ultrasnabba tidsskalan för molekylära rörelser.

Fig. 2:Överst:Molekylstruktur av ett kontaktjonpar som består av dimetylfosfat (DMP) och en magnesiumjon Mg2 inbäddad i vatten. Pilarna markerar förlängningen av fosfor-syrebindningarna i den asymmetriska PO2-sträckande vibrationen. Nederst:Tvådimensionella infraröda (2D-IR) spektra för den asymmetriska PO2-sträckningsvibrationen mätt vid en väntetid T =500 fs efter vibrationscitation. Vibrationsresponsen visas som en funktion av den infraröda exciteringen och detektionsfrekvenserna och består av en komponent P1 från DMP-molekyler utan en magnesiumjon i närheten och bidraget P2 från kontaktjonpar. Den senare skiftas till högre frekvenser på grund av interaktionen mellan PO2- och Mg2 . Upphovsman:MBI Berlin
I en nyligen publicerad publikation, forskare från Max Born Institute (MBI) visar att vibrationer i fosfatgrupper representerar känsliga och icke -invasiva sonder för jongeometrier i en vattenmiljö. Dimetylfosfat (DMP, (CH 3 O)2PO 2- ), ett etablerat modellsystem för DNA- och RNA-ryggraden, bereddes i flytande vatten med ett överskott av Mg 2+ joner (Figur 2, top) och studeras med icke-linjär vibrationsspektroskopi i femtosekundtidsdomänen (1 fs =10 -15 s). Experimenten använder sig av tvådimensionell infraröd (2-D-IR) spektroskopi, en mycket sofistikerad metod för att analysera joninteraktioner och strukturer på den inneboende tidsskalan för fluktuerande molekylära rörelser.
Experimenten kartlägger Mg 2+ joner i direkt kontakt med en PO 2- grupp via en distinkt funktion i 2-D-IR-spektrumet (figur 2, botten). Interaktionen med Mg 2+ jon skiftar den asymmetriska PO 2- sträcka vibrationer till en frekvens som är högre än i frånvaro av Mg 2+ joner. Linjeformen och tidsutvecklingen av denna nya funktion avslöjar fluktuationer i kontaktjonparets geometri och det inbäddade vattenskalet på en tidsskala av hundratals femtosekunder medan själva kontaktparet existerar mycket längre tider (~10 -6 s). En djupgående teoretisk analys visar att den subtila balansen mellan attraktiva elektrostatiska (Coulomb) krafter och repulsiva krafter på grund av den kvantmekaniska utbytesinteraktionen styr fosfatvibrationens frekvensposition.
Förmågan hos 2-D-IR-spektroskopi att karakterisera kortdistansfosfatjoninteraktionen i lösning ger ett nytt analytiskt verktyg som kompletterar nuvarande tillgängliga strukturella tekniker. En förlängning av denna nya inställning till DNA och RNA och deras joniska miljö är mest lovande och förväntas ge ny insikt i de krafter som stabiliserar jämviktsstrukturer och driver veckningsprocesser.