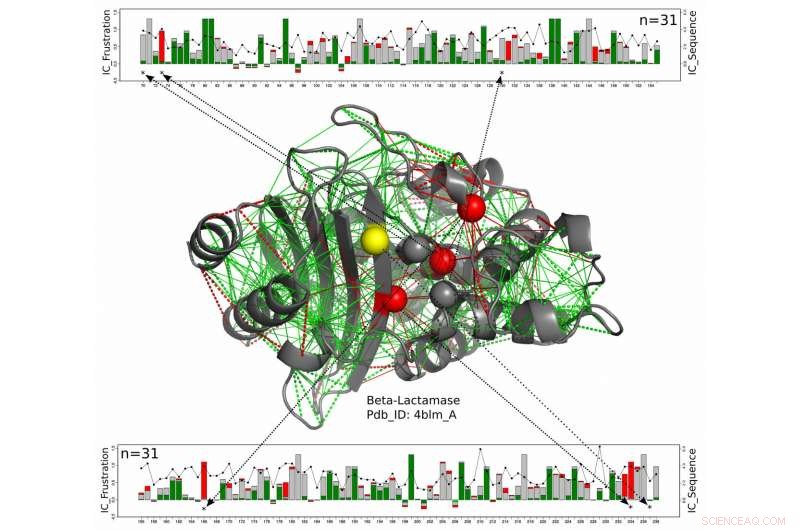
I denna strukturella modell för ett beta-laktamasprotein, katalytiska rester visas som sfärer med de som genomgående är mycket frustrerade längs hela beta-laktamasfamiljen som visas i rött och de för vilka det frustrerade tillståndet inte är konserverat i gult. Det nya arbetet av forskare vid Rice University, University of Buenos Aires och European Molecular Biology Laboratory föreslår dessa enzymer, som måste förbli utsatta för att reagera med sina mål, få ett mått på skydd mot de något frustrerade aminosyrorna runt dem. De gröna linjerna representerar minimal frustration, de röda linjerna representerar stor frustration. De linjära diagrammen upptill och nedtill visar positionerna för de relevanta aminosyrorna på proteinkedjan och ett mått på energibesparingen över hela beta-laktamaser-proteinfamiljen. Upphovsman:Maria Feiberger/University of Buenos Aires
Proteiner viker enligt ett manus skrivet i mönstret för deras aminosyror. Men för att fungera korrekt, vissa delar måste ad-lib.
De aktiva platserna för enzymer, proteiner som påskyndar och styr biokemiska reaktioner, göra livet möjligt. Att göra detta, deras instruktioner måste komma i konflikt med proteinets övergripande strukturplan, enligt forskare vid Rice University, universitetet i Buenos Aires och European Molecular Biology Laboratory i Heidelberg, Tyskland.
Enligt forskarna, evolutionen har valt delar av enzymer som tillräckligt viktiga för att energiskt kunna avvika från instruktionerna som leder till en viktratt, som styr proteinerna in i deras funktionella lågenergitillstånd. Genom att undersöka i princip alla kända enzymer, forskarna bekräftade också misstanken att ytterligare nivåer av mer svagt frustrerade interaktioner omger och stöder själva de katalytiska platserna.
Teorin som beskrivs i Proceedings of the National Academy of Sciences utvidgar den accepterade principen om minimal frustration som förklarar varför proteiner smidigt kan utvecklas från de linjära sekvenserna som ursprungligen kodades i deras DNA till deras arbete, tredimensionella globulära former. Denna princip erkänner det faktum att frustration ofta blir olöst när den återstående energikonflikten på något sätt tjänar proteinets funktion.
Enligt Rice's Peter Wolynes, som förklarade principen i matematisk form för mer än 20 år sedan, energilandskapen för proteiner med katalytiska delar är värda en extra analys, med tanke på den vikt evolutionen har tilldelat dem.
"En perfekt vikt molekyl, oavsett hur vacker som en skulptur, kan inte göra så mycket, "sa han." Du måste ha ett protein som medan den mestadels viks, har fortfarande några frustrerade gångjärn som är oförenliga med vikning men som är nödvändiga för att möjliggöra rörelse som krävs för kemiska reaktioner. "
Frustration på atomnivå är enkel att uppleva:Tryck bara ihop de positiva polerna på två magneter och känna hur de skjuter tillbaka. Som magneter, aminosyrorna i ett vikande protein lockar och stöter bort varandra när de (mestadels) löser konflikter och slutligen bildar ett stabilt arrangemang av kontakter.
"Lägg nu till en tredje magnet, och du kan stöta på frustration som du inte kan bli av med, "sa medförfattaren Wolynes, som arbetade med Buenos Aires -teamet under ledning av biologisk kemist Diego Ferreiro, en tidigare postdoktor i sin grupp.
Den nya studien visar att frustration bland enzymets närliggande aminosyror, som i situationen med den tredje magneten, verkar för att hjälpa det frustrerade enzymet att stå sig. Det förblir något instabilt men har regioner tillgängliga att binda med och modifiera målmolekyler.
Klart, Wolynes sa, evolution har prioriteringar som överträffar estetiken i att uppnå en perfekt vikning.
Forskargruppen undersökte beräknat hundratals kända proteinstrukturer och upptäckte att hela familjer av enzymer delar karaktäristiska signaturer av frustration på aktiv plats som sträcker sig till det andra och tredje aminosyralagret, eller skal, runt enzymet.
"Det intressanta vi fann var att frustration i allmänhet sträcker sig bortom det absoluta första skalet, "sa han." Det betyder att det finns en besvärlig men nödvändig subtilitet till de funktionella begränsningarna som kräver att dessa tre skal blir rätt. "
Wolynes noterade Nobelpristagaren Frances Arnold och andra som studerar artificiell utveckling i laboratoriet har sett tecken på utökad frustration i sina ansträngningar att modifiera enzymer för nya reaktioner.
"Ibland skulle de specifikt ändra den aktiva platsen för att katalysera olika kemiska reaktioner från de naturliga, men fann att aminosyror avlägsna från den aktiva platsen också behövde förändras för att få enzymet att fungera effektivt, "sa han." Det var inte uppenbart varför, men modellerna visar att förändringar i det andra och tredje skalet förbättrar enzymets katalytiska förmåga.
"Så våra resultat var inte en fullständig chock, men det är trevligt att se att utökad frustration är ganska utbredd i naturen och är ett vanligt tema genom alla kända enzymklasser, " han sa.