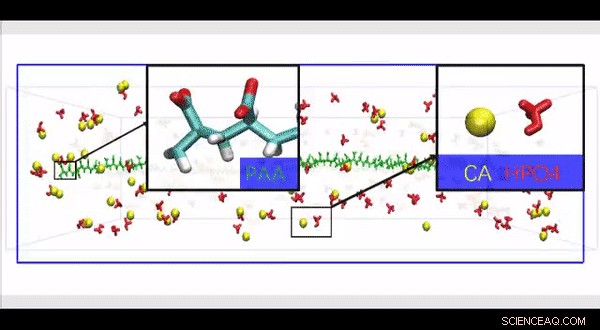
Full atomistisk molekylär dynamiksimulering av en högupplöst HPAA-kollagenstruktur konstruerad för att undersöka effekten av närvaron av stora polyelektrolytmolekyler längs ytan av kollagenfibrill på rörelse och infiltration av joner i en biomimetisk modell. Upphovsman:Science Advances, doi:10.1126/sciadv.aav9075.
Levande organismer bildar biologiska mineraler under biomineralisering, där oorganiska element selektivt kan avsättas på specifika organiska makromolekyler under exakt kontroll. Processen kan delas in i biokalkning eller biosilicifiering baserat på den oorganiska komponenten, med kollagen som en universell mall. Under intrafibrillar mineralisering, kollagenmatriser som är avsedda för mineralisering hos ryggradsdjur innehåller ytbundna matrisproteiner. Att förstå de komplexa mekanismerna för intrafibrillär mineralisering för att bilda hård kollagen vävnad såsom ben och dentin är av betydande intresse för biomekanik, med decennier av studier som genomförts för att efterlikna eller modellera processen i laboratoriet. I en färsk studie, nu publicerad i Vetenskapliga framsteg , Q. Sång och medarbetare vid de tvärvetenskapliga biologiska institutionerna, Tillämpad fysik, Materialvetenskap och teknik, Biomedicinsk vetenskap och tandläkare, i Kina, USA och Italien, har utvecklat en biomekanisk modell för att undersöka kollagen-ligand-interaktioner som bidrar till intrafibrillär mineralisering.
I studien, de använde negativt laddade, polykarboxylsyra med hög molekylvikt, tvärbunden till rekonstituerat kollagen, för att skapa den biomimetiska modellen. De genomförde simuleringar av kryogen elektronmikroskopi och molekylär dynamik, för att visa att kedjeliknande aggregat bildas efter tvärbindning till kollagen, längs fibrillarytan för att genomföra fibrillar mineralisering. De observerade att de negativt laddade, mineraliserade ställningar tillät dem att uppnå högre kvalitet med bättre biomekaniska egenskaper, jämfört med mineralisering på omodifierade ställningar. Arbetet med kollagen-ligand-interaktion gav forskarna insikter om ursprunget till heterogent mineraliserade vävnader och klargjorde också de potentiella orsakerna till ektopisk förkalkning (olämplig biomineralisering) i icke-mineraliserade kroppsvävnader.
Biomineraler som förekommer i naturen innehåller i sig kalcium för att bilda kalciumfosfat (CaP) och oktakalciumfosfat som exempel. CaP-innehållande biomineraler utgör specifikt vertebrala hårda bindväv, medan kalciumkarbonat bildar det ryggradslösa skelettet. Kollagenfibriller kan användas som mineraliseringsmallar på grund av nanoskala kanaler i deras fibrillära strukturer för att bilda nano -motoriserade hybrider med kombinerad styrka och motståndskraft. Dock, processen kan inte uppnås genom att helt enkelt doppa kollagenmatriser i en övermättad lösning av mineraljoner, i stället kräver användning av kärnbildningshämmare för att stabilisera jonföreningskomplex och förhindra deras kristallisering utanför fibrillerna. Som ett resultat, under det senaste årtiondet, forskare har föreslagit olika in vitro -modeller för att förstå mekanismerna för intrafibrillär mineralisering. I de föregående studiemodellerna, hämmare av kristallkärnbildning inkluderades i mineraliseringsmediet och var inte bundna till kollagenfibrillerna, avviker från det typiska scenario som inträffade i biologiska system. I den nuvarande studiemodellen, Song et al. tillät därför inhibitorerna att binda kollagenfibrillerna för adekvat biomimik.
Karakterisering av PAA-kollagen. (A) Infraröda spektra av PAA-kollagensvampar. Spektra normaliserades längs kollagenamid A -toppen (~ 3300 cm − 1, NH -stretch i kombination med vätebindning) Jämfört med spektrumet av bart kollagen, spektra av HPAA-bunden kollagen (HPAA-kollagen) och LPAA-bundet kollagen (LPAA-kollagen) svampar visar ökningar i amid B, Jag, II, och III -toppar. (B) Solid yta ζ potential för HPAA-kollagen, LPAA-kollagen, och rent kollagen. Tvärbindning av PAA till kollagenmolekylen resulterade i signifikant lägre ζ potentialer på -17,17 ± 1,98 mV för HPAA-kollagen, −15,19 ± 1,22 mV för LPAA-kollagen, och -3,04 ± 0,37 mV för bar kollagen. (C och D) Jämförelse av karboxyl (C) och amingrupper (D) mellan PAA-kollagen och bar kollagen. Efter anjonisk modifiering, mängderna av karboxylgrupp (i mM/g kollagen) i HPAA-kollagenet (1,907 ± 0,084) och LPAA-kollagen (1,807 ± 0,035) var signifikant högre än för det nakna kollagenet (0,460 ± 0,017). Upphovsman:Science Advances, doi:10.1126/sciadv.aav9075. 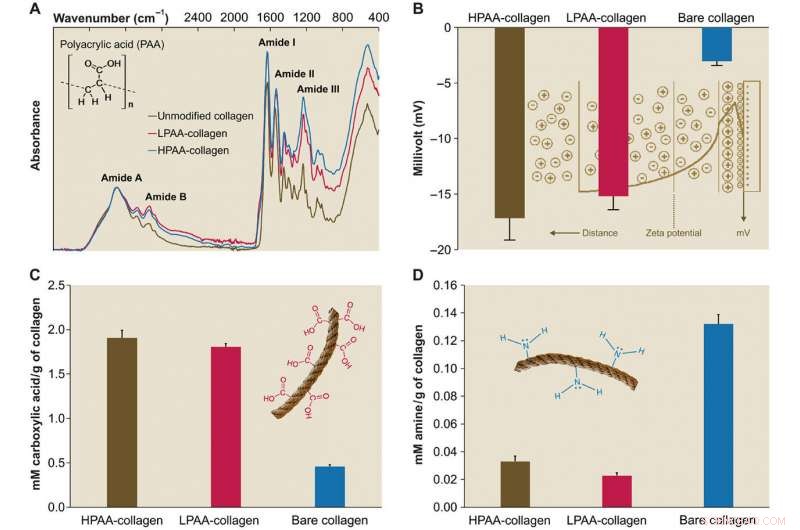
Eftersom fysiologiska icke -kollagena proteiner är svåra att extrahera och funktionellt komplexa för användning i biomimetiska mineraliseringsstudier, Song et al. använde anjoniska polyelektrolyter som kärnbildningshämmare i sin modell för intrafibrillär mineralisering. Anjoniska polyelektrolyter kan efterlikna den mycket anjoniska och egensjukade proteinkonformationen som finns i icke -kollagena proteiner. I den föreslagna modellen, polyelektrolytkärnbildningsinhibitorerna bundna till matrisproteinfritt rekonstituerat kollagen som modeller för intrafibrillär mineralisering. Song et al. simulerade först molekylär dynamik för att visa att en polyelektrolyt såsom polyakrylsyra (PAA) kunde reservera kalcium- och vätefosfatjonkomplex till kedjeliknande aggregat längs makromolekylens yta vid införande i ett övermättat CaP-mineraliseringsmedium.
Baserat på den simulerade molekylära dynamiken, Song et al. utvecklat en testhypotes om att en kärnbildningshämmare bunden till ytan av kollagenfibriller skulle kunna stabilisera CaP -mineraliseringsprekursorer nära fibrillerna, för effektiv intrafibrillär mineralisering. För att testa hypotesen, de använde kontroller med en obunden version av samma polyelektrolyt som används för att stabilisera CaP -prekursorerna som ingår i mineraliseringsmediet istället.

Simulera den sena fasen av intrafibrillar mineralisering av HPAA-kollagen. 3D-rendering av den sena fasen av intrafibrillär mineralisering av HPAA-kollagen som visar ackumulering av prenukleationsklusteraggregat (gula) längs fibrilytan; intrafibrillära mineraler avbildas i orange. Upphovsman:Science Advances, doi:10.1126/sciadv.aav9075.
Forskarna använde högmolekylär polyakrylsyra - PAA (HPAA) för att simulera osteopontin och lågmolekylär PAA (LPAA) för att simulera osteocalcin. De tvärbinder kemiskt de polyanjoniska elektrolyterna för att rekonstituera typ I -kollagenfibriller eller -svampar med hjälp av organiska föreningar och undersökte polymerkonstruktionen med hjälp av Fourier -transform infraröd spektroskopi (FTIR). Song et al. använde transmissionselektronmikroskopi (TEM) för att observera PAA-bundna kollagenfibriller som var färgade röda och registrerade dem som elektrontäta trådformiga aggregat på fibrilytan. De använde sedan högpresterande vätskekromatografi för att undersöka egenskaperna för bindning/frisättning av PAA-kollagensvampar.
Simulering av biomineraliseringens molekylära dynamik
För att förstå de olika faserna av intrafibrillar mineralisering av HPAA-bundet kollagen (HPAA-kollagen), forskarna skapade filmer med hjälp av elektrontomografidata från de olika faserna av biomineralisering. De simulerade den (1) tidiga fasen - för att visa ackumulering av prenukleationsklusteraggregat runt det icke -mineraliserade kollagenfibrillet, (2) mittfas - för att visa partiell intrafibrillär mineralisering och (3) sen fas - för att visa kraftig intrafibrillär mineralisering av HPAA -kollagenfibrillerna. De visade att LPAA-kollagen inte inducerade intrafibrillar mineralisering jämfört med HPAA i studien, och inkluderade därför inte polymererna i de efterföljande experimenten.

Molekylära dynamik simuleringar. (A) Profil av mikrofibrillära strukturer med kollagen med vattenmolekyler inom de intrafibrillära utrymmena. Blå band, kollagen trippel spiraler; röda prickar, vattenmolekyler. (B) sidovy av nakna kollagenmikrofibriller. De blå linjerna beskriver den 67 nm långa simuleringsrutan. (C och D) Förflyttning av Ca2+ (gula kulor), HPO42− (röda sammansättningar), och monterade CaP-mineraliseringsprekursorer (gulröda sammansättningar) över kollagenmikrofibriller med HPAA (grön kedja) bunden till LYS1099-aminosyrorna i kollagenmolekylerna. (E) Topp:Simulering av rörelsen av olika joner över HPAA-kollagenmikrofibrillära strukturer vid angivna simuleringstider. Blå sfärer, lila sfärer, gula kulor, röd montering, gulröda sammansättningar, och grön kedjestruktur representerar Na+ joner, Kloner, Ca2+ joner, HPO42− joner, CaP -mineraliseringsprekursorer, och HPAA, respektive. Nederst:Dynamiska förändringar i antalet Ca2+ (svart linje), HPO42− (röd linje), Na+ (grön linje), och Cl- (blå linje) i intrafibrillära och extrafibrillära områden längs a-axelgränsen vid 0, 30, 50, och 70 ns. (F) Förflyttning av Ca2+, HPO42−, och monterade CaP -mineraliseringsprekursorer över de rena kollagenmikrofibrillerna med obundet HPAA i den extrafibrillära regionen (kontroll). (G) Jämförelse av fördelningen av olika joner inom den intrafibrillära regionen i den kollagenbundna HPAA och obundna HPAA-mineraliseringsmodellerna. (H) Jämförelse av rotmedelskvadratavvikelse för kollagenmolekyler i de kollagenbundna HPAA- och obundna HPAA-modellerna. (I) Jämförelse av lösningsmedeltillgänglig ytarea (SASA) för kollagenmolekylerna mellan de två modellerna. Upphovsman:Science Advances, doi:10.1126/sciadv.aav9075.
Song et al. använde därefter molekylära dynamiksimuleringar av mineraliseringsprocessen för att förstå förhållandet struktur-till-funktion och validerade förmågan hos kollagenbundet HPAA att aggregera CaP-mineraliseringsprekursorer. För detta, de använde en fullständig atomistisk modell av det hydratiserade HPAA-kollagenfibrilkomplexet. I enhetsmodellen, de simulerade Ca 2+ och HPO 4 2- joner och sammansatta CaP-mineraliseringsprekursorer för att bildas runt det kollagenbundna HPAA. Arbetet avslöjade fördelningen av natriumjoner, klorid, kalcium och HPO 4 2- joner längs axeln för enhetsmodellgränsen.
Undersöker ultrastrukturen
För ultrastrukturella undersökningar av den biomimetiska modellen, Song et al. använde nanoindentation för att bedöma Youngs moduler av mineraliserade och icke -mineraliserade kollagenfibriller med atomkraftmikroskopi (AFM). Värdena var liknande de som tidigare rapporterats för mineraliserade och icke -mineraliserade fibriller, beräknas med hjälp av nanoindentation. Forskarna använde röntgendiffraktionsspektroskopi för att identifiera förekomsten av apatit på de mineraliserade svamparna. Studien visade att HPAA-kollagen mineraliserat i CaP-lösning i sju dagar hade högre mineralinnehåll än bar kollagen. När Song et al. beräknat förhållandet apatit/kollagen i de spektroskopiska profilerna, HPAA-kollagensvamparna indikerade högre mineraliseringsnivåer.
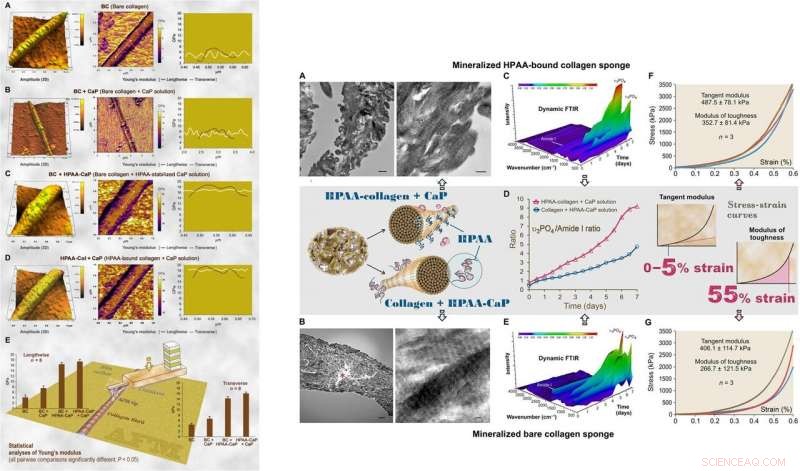
:VÄNSTER:AFM för 3D-ytopografi och elasticitetsmodul (Youngs modul) kartläggning av representativ lufttorkning, mineraliserat nakent kollagen och HPAA-kollagenfibriller. (A) Bare kollagenfibriller (BC) hade en nära normal fördelning av Youngs modul tvärs över fibrillen. (B) Bare kollagen mineraliserat i CaP -lösning utan kärnbildningshämmare (BC + CaP). (C) Bare kollagen mineraliserat med HPAA-CaP-lösning (BC + HPAA-CaP). (D) HPAA-kollagen mineraliserat med CaP-lösning utan kärnbildningshämmare (HPAA-Col + CaP). (E) Statistiska analyser av Youngs modul för kollagenfibrill i längdriktningen och tvärriktningen (n =8). HÖGER:Karakterisering av mineraliserade HPAA-kollagensvampar och nakna kollagensvampar. (A) TEM för mineraliserade HPAA-kollagensvampar. (B) TEM för mineraliserade nakna kollagensvampar. (C) Dynamisk dämpad total reflektion (ATR) –FTIR visar progressiv mineralisering av en HPAA-kollagensvamp med 12 timmars intervall under en 7-dagarsperiod. (D) Förändringar i förhållandet apatit υ3PO4/kollagenamid I mellan mineraliserade anjoniska kollagensvampar och omodifierade kollagensvampar. E) Dynamic ATR-FTIR visar hur mineraliseringen av en naken kollagensvamp utvecklas i HPAA-CaP-lösning. (F) Stress-töjningsrespons hos mineraliserade HPAA-kollagensvampar för bestämning av tangentmodul och seghetsmodul (infälld, mittrad). (G) Stress-töjningsrespons av mineraliserade nakna kollagensvampar. Upphovsman:Science Advances, doi:10.1126/sciadv.aav9075.
Seghetens modul, vilket typiskt indikerar energin per volymenhet som ett material kan absorbera innan det brister, var också signifikant högre för HPAA-kollagensvampar som indikerar frakturresistens hos materialet. Sådana egenskaper står för den höga motståndskraften hos biomineraliserade kollagenbaserade vävnader som efterliknar benmikroarkitektur för att kombinera benegenskaperna hos seghet och styrka vid regenerativ teknik. Song et al. krediterade de observerade egenskaperna hos kohesiv/vidhäftning till HPAA -tvärbindning, som gjorde det möjligt att skapa kollagen/mineralkomposit, liknande det tvärbundna osteopontinet som finns i benarkitektur.
Tillämpningar av de nya biokompatibla konstruktionerna
Eftersom biokompatibilitet för nya material är en viktig egenskap inom materialvetenskap och bioingenjör, Song et al. verifierade gynnsamma cell-material-interaktioner på HPAA-tvärbundet kollagen med användning av stamcells livskraft och spridning under cellodling av benregenerering i laboratoriet. När forskarna genomförde mitokondriella dehydrogenas- och apoptosanalyser på mänskliga mesenkymala stamceller, de observerade inte signifikanta skillnader mellan det unmineraliserade HPAA-kollagenet och nakna kollagensvamparna. På grund av deras kompatibilitet med humana osteoblastliknande celler, sådana material kan användas som biokompatibla beläggningar för kirurgiska implantat.
På det här sättet, Song et al. demonstrerade en biomekanisk modell för förbättring av intrafibrillar mineralisering med hjälp av kollagen-ligand-interaktioner för att förstå de platsspecifika mekanismerna. Denna modell av kollagen-ligand-interaktioner kan också belysa de potentiella orsakerna till ektopisk mineralisering, som är av intresse för närvarande. I perspektivet av Song et al., intrafibrillar mineralisering via kollagen-ligand-interaktioner kan infiltrera mineraler mer konsekvent i kollagenmatriser för bulk för tillämpningar inom regenerativ medicin. Resultaten hjälper till att förstå de biomekaniska egenskaperna, samtidigt som man minskar brister för att öka de biomimetiska egenskaperna hos en mineraliserad kollagenmatris inom vävnadsteknik.
© 2019 Science X Network