Här är det periodiska systemet med alla element blockerade förutom de i grupp 15. Kredit:Julie Pollock, CC BY-SA
När du ser det periodiska systemet, vad tänker du på? Bitarna på en scrabble board? Kanske tänker du på din gymnasiekemi. Kanske tänker du på det färgglada bordet på väggen i en föreläsningssal på college. Kanske kommer du ihåg att din favoritlärare eldade något framför klassrummet. Jag är biträdande professor i kemi vid University of Richmond och när jag hör frasen "det periodiska systemet, "Jag tänker på livet.
Jag tänker på hur molekylerna och kemikalierna som omger oss och dikterar våra dagliga aktiviteter består av elementen på bordet - de upprätthåller vårt liv, de ger skönhet till världen och de är viktiga inom medicin.
Varje kolumn i det periodiska systemet kallas en grupp. Varje medlem i gruppen har ett liknande arrangemang av elektroner som kan resultera i liknande kemiska egenskaper. Grupp 15 element - kväve, fosfor, arsenik, antimon, vismut och moskov - är intressanta för mig på grund av deras avgörande roll i livet, liksom i mitt forskningslabb. Ett element vi studerar är fosfor på grund av dess integrerade roll i cellernas öde.
Men innan vi går in på dessa detaljer, låt oss ta en kort titt på var och en av gruppens 15 element. De är en unik uppsättning i sin historia, användningsområden och egenskaper.
Grupp 15 - att ge liv och orsaka död
Kväve (N) i sin atmosfäriska form (N₂) utgör cirka 78% av luften vi andas. När bakterier som lever inom växtrötter omvandlar den till en användbar form genom en process som kallas kvävefixering, denna elementära form av kväve införlivas i många föreningar som är nödvändiga för livet - proteiner och DNA, till exempel. Längst ner i kolonnen finns Moscovium (Mc), vilket är intressant eftersom det inte finns i naturen. Det är ett radioaktivt element som bara kan genereras i ett laboratorium och överlever i mindre än en sekund.
Arsenik (As) kan vara bekant för dig på grund av dess koppling till förgiftningar. År 1494, Pico della Mirandola, en italiensk humanistisk filosof under renässansen, förgiftades av arsenik, även om detaljerna kring hans tidiga död fortfarande diskuteras. Under lång tid trodde man att Napoleon Bonaparte dog av arsenikexponering 1821, men efter omfattande jämförelser av bevarade hårprover från olika stadier av hans liv, forskare drog slutsatsen att de ökade halterna av arsenik troligen berodde på dåtidens konserveringstekniker. På senare tid, Världshälsoorganisationen uppskattade arsenikförorenat dricksvatten i Bangladesh resulterade i över 9, 000 dödsfall år 2001. Hur arsenikförgiftningar och dödande inte helt förstås, men det råder ingen tvekan om att elementet orsakar förstörelse av vitala organ i människokroppen.
När elementet antimon (Sb) kombineras med tre syreatomer för att bilda antimontrioxid, det används flitigt som flamskyddsmedel för möbler, mattor, gardiner, sudd, plast och lim. Mängderna av denna molekyl i dessa hushållsprodukter tenderar att vara mycket små, och dessa nivåer av antimon anses vara säkra.
Bismut (Bi) är en metall som finns i samma rad i det periodiska systemet som ett antal giftiga metaller; dock, föreningar som innehåller vismut är ofarliga. Vismutföreningar kan hittas i kosmetika på grund av deras distinkta och önskvärda silverfärgade skimmer. Även om du inte har använt vismuthaltiga produkter för personlig vård, du har förmodligen stött på det i den välkända antacida Peptobismol, som används för att behandla magbesvär, eller den fjärde juli när du tittar på fyrverkerier. Det är en vismutförening som orsakar sprakande ljud från dragonäggfyrverkerierna.
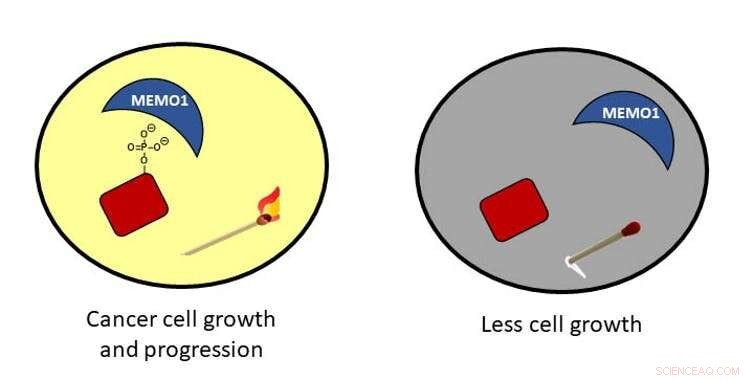
Fosforylering i cancerceller:När ett protein fosforyleras, det är som en tänd tändstick i ett rum som leder till cancercelltillväxt. Om fosfatet avlägsnas, matchen är släckt och cellerna växer inte så mycket.
Sista, men inte minst, av gruppen 15 element är fosfor (P). Det upptäcktes 1669 av alkemisten Hennig Brandt och namngavs från det grekiska ordet "phosphoros, "vilket betyder att det ger ljus. Det beror på att när elementformen interagerar med atmosfäriskt syre ger det ett strålande ljus. Kemister räknade ut hur man utnyttjar kraften i denna reaktion för utveckling av tändstickor. Den röda spetsen på en tändsticka innehåller fortfarande en form av fosfor idag.
Fosfater - reglerar cancercells öde
Förutom gnistor som genereras av elementet, fosfor finns i en förening som kallas fosfat:fosfor kopplad till fyra syreatomer. I celler, när en fosfatmolekyl är bunden till ett protein, det kan slå på, eller aktivera, proteinet så att det kan utföra sin funktion i cellen - som stimulerande tillväxt.
När fosfatet inte längre är fäst vid proteinet, cellerna slutar växa. Du kan tänka på det nästan som matcherna som beskrivs ovan - när fosfatet är där, matchen kan antändas och affärer kan fortsätta. När fosfatet avlägsnas, matchen är bara en pinne och inget ljus tillhandahålls; inte så mycket arbete kan hända i mörkret.
I cancerceller, fosfatstatus är utom kontroll. Tänk dig många tända tändstickor och ett mycket ljust rum som kan resultera i en uppsjö av aktivitet. Denna aktivitet kan få allvarliga konsekvenser för celler. Till exempel, oreglerad tillväxt och migration kan leda till cancer.
I mitt laboratorium vid University of Richmond, Vi är intresserade av att förstå dessa fosfater och särskilt ett protein som interagerar med dem. Detta protein, kallad MEMO1, finns i stora mängder hos bröstcancerpatienter och hjälper fosfaterna att alltid hålla fast vid proteiner. Vi försöker förstå hur MEMO1 interagerar med dessa fosfater och utvecklar strategier för att störa dessa interaktioner.
Vi hoppas att vårt arbete avslöjar ett sätt att hjälpa till att avlägsna fosfaterna för att stoppa den okontrollerade celltillväxten - med andra ord, att blåsa ut tändstickorna.
Så nästa gång du hör orden "periodiska systemet, "snälla tänk på livet. Tänk på molekylerna som du möter varje ögonblick varje dag, tänk på medicinen som håller dig frisk och tänk på oss som arbetar för att förstå hur du håller dig på det sättet.
Denna artikel publiceras från The Conversation under en Creative Commons -licens. Läs originalartikeln. 