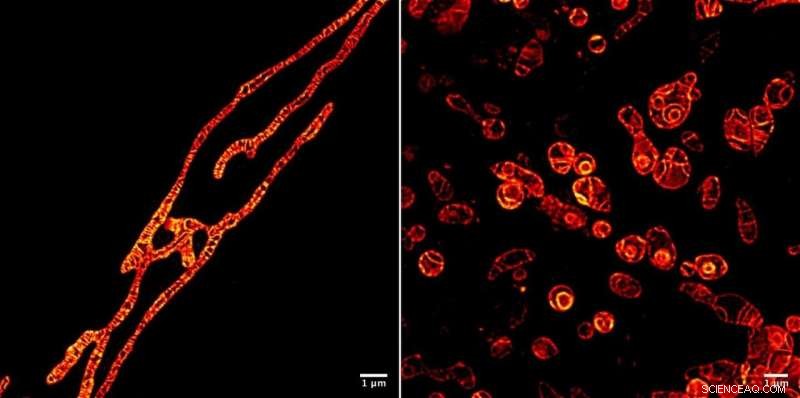
Inre membran i levande mitokondrier under ett STED-mikroskop avbildat med MitoPB Yellow fluorescerande markörmolekyl skapad av forskare vid Institute of Transformative Bio-Molecules (ITbM) vid Nagoya University. Mitokondriernas yttre membran är osynliga. Markörmolekylen tål STED -strålen under relativt lång tid, vilket möjliggör time-lapse-avbildning av det levande subjektet. Provberedning är mycket lättare för ett optiskt mikroskop än ett transmissionselektronmikroskop (TEM), kräver ungefär en timme snarare än en dag. Celler kan inte avbildas levande med TEM. Mitokondrier har behandlats med ett reagens som undertrycker DNA -replikation, framkalla dysfunktion, för att se deras överlevnad (vänster) och döende (höger) processer. Att kunna se dysfunktionsprocesserna som uppstår i mitokondrier kommer att leda till ett bättre sätt att diagnostisera mänsklig mitokondriell sjukdom - och kanske till och med ett botemedel. Upphovsman:© ITbM, Nagoya universitet
Ljusmikroskopi är det enda sättet på vilket vi kan titta inuti en levande cell, eller levande vävnader, i tre dimensioner. Ett elektronmikroskop ger bara en tvådimensionell vy, och det organiska provet skulle snabbt brinna upp på grund av den extrema värmen i elektronstrålen, och kan därför inte observeras levande. Dessutom, genom att markera biomolekylerna i strukturen vi är intresserade av med en specialdesignad fluorescerande molekyl, vi kan skilja det från omgivningen:detta är fluorescensmikroskopi.
Fram till mitten av 1990-talet hindrades fluorescensmikroskopi av grundläggande fysik:på grund av diffraktionsgränsen, alla funktioner på provet närmare varandra än cirka 250 nanometer skulle suddas ut tillsammans. Virus och individuella proteiner är mycket mindre än detta, så de kunde inte studeras på detta sätt. Men omkring 1994, i en underbar lektion som lär oss att vi måste vara försiktiga när vi tillämpar grundläggande fysiska principer, Stefan Hell upptäckte Stimulated Emission Depletion (STED) mikroskopi, som nu är en av flera metoder för optisk mikroskopi som uppnår "superupplösning, "upplösning bortom diffraktionsgränsen. Han fick Nobelpriset i kemi 2014" för utvecklingen av superupplöst fluorescensmikroskopi, "tillsammans med Eric Betzig och William Moerner.
För att se varför diffraktionsgränsen är ett problem, tänk att strukturen av intresse är mycket liten, säga, 50 nanometer över, som ett virus, och har markerats med en fluorescerande biomolekyl. Tänk dig nu att belysa den med en laserpunkt, säga, 200 nanometer i diameter. De upplysta markörmolekylerna avger ljus spontant, slumpmässigt, genom fluorescens, med sannolikheten sjunker snabbt med tiden. Fotonerna från många fluorescerande molekyler är fokuserade på en detektor med hjälp av linser, skapa en enda bildlös pixel. Det är inte helt ljust eftersom endast en liten del av provet i den upplysta cirkeln innehåller fluorescerande molekyler. Om du skulle flytta lasern 200 nanometer i någon riktning, vart, i detta exempel, inga fluorescerande molekyler finns, signalen kommer säkert att bli mörk. Så, denna ganska svaga pixel berättar att något är närvarande inuti detta provområde 200 nanometer i diameter. Diffraktionsgränsen hindrar oss från att bilda pixlar från mindre områden, om vi använder det grundläggande tillvägagångssättet.
Den fysiska idén med STED -mikroskopi är mycket enkel. Med laserpunkten som belyser området runt den lilla fluorescerande strukturen igen, antar att du på något sätt hindrar ljus från att skickas till detektorn från ett så stort område som möjligt inom platsen - lämnar en mycket mindre plats, säga, 60 nanometer i diameter. Om du nu flyttar lasern 60 nanometer i någon riktning och signalen blir mörk, pixeln i bilden representerar närvaron av struktur upp till 60 nanometer över. Diffraktionsgränsen har slagits. Självklart, en sådan pixel är utan prestanda, men en skarp bild av mitokondrier kan byggas upp genom att skanna över och spela in många pixlar med varierande ljusstyrka. (Se figur 1. "Time-gated STED Microscopy" användes för att fånga de flesta bilderna i detta papper.)
Stefan Hells Nobelprisvinnande upptäckt består av två insikter. Först, han tänkte på tanken att stoppa ljus som skickas till detektorn från ett så stort område som möjligt inom en upplyst plats vars storlek matchar diffraktionsgränsen. Andra, han kom på hur han faktiskt skulle uppnå det.
Två lasrar belyser samma plats. Den första lasern upphetsar markörmolekylelektronerna och de förfaller spontant tillbaka till sitt marktillstånd, var och en avger en synlig foton med en specifik våglängd. (Detta är fluorescens.) Processen är slumpmässig, med utsläppssannolikheten minskar med tiden ganska snabbt, vilket betyder att de flesta fotoner avges inom de första nanosekunderna i det prov som belyses. En andra laser, "STED -strålen, "formad med ett hål i mitten för att inte påverka markörmolekylerna där, är inställd för att stimulera emission av en foton av den exciterade markörmolekylen i den yttre ringen. Men hur skiljer sig dessa fotoner från fotoner som avges från mitten?
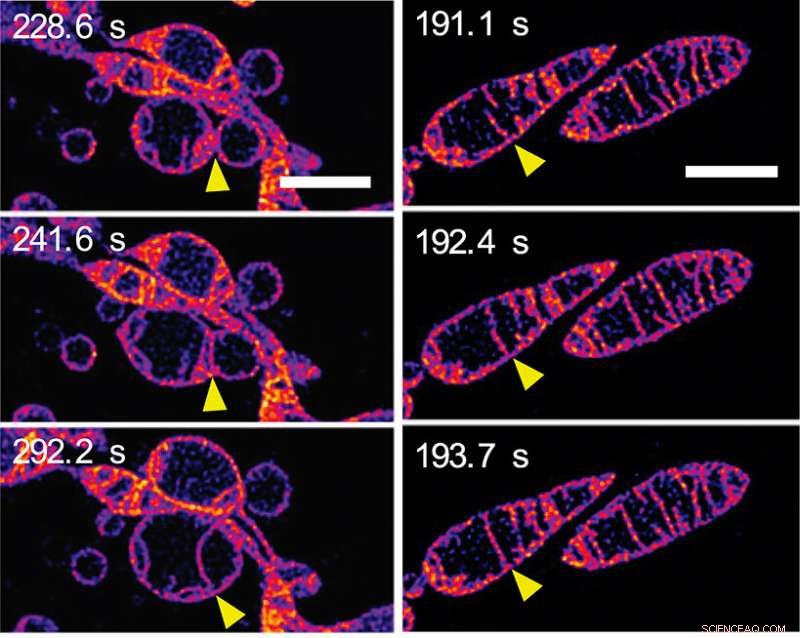
Som svar på att bli berövad näringsämnen, mitokondrier smälter ihop och ökar antalet cristae. (a) Ramar från en time-lapse-sekvens som visar två separata mitokondrier som smälter samman för att bilda en enda mitokondrion. Mitokondriernas yttre membran är osynliga:vi ser de inre membranen smälta ihop. (b) Ramar från en time-lapse-sekvens som visar två cristae inuti en enda mitokondrion som smälter ihop. (Se Video 2 i tilläggsmaterialet på papprets PNAS -webbsida.) Skalstaplarna representerar 2 mm. Upphovsman:© ITbM, Nagoya universitet
Utsläppsprocessen från den yttre ringen är också slumpmässig men sker mycket snabbare, sannolikheten minskar snabbt, vilket betyder att de flesta av dessa fotoner avges inom en nanosekund eller så. När de två överlagrade strålarna skannar över provet, när ringens mitt fluorescerar, de omgivande molekylerna har redan tvingats till sitt grundläge genom att avge en foton - de har "stängts av". STED -mikroskopitekniken bygger på smart timing på detta sätt. I princip, storleken på den glödande centrala platsen kan göras så liten som du vill, så någon upplösning är möjlig. Dock, den munkformade "STED-strålen" skulle då leverera energi i form av koncentrerat synligt laserljus till ett större område av den levande cellen, riskerar att döda den.
Ändå, processen är inte idealisk, och den resulterande bilden förlorar viss skärpa eftersom vissa markörmolekyler i den yttre ringen inte är korrekt avstängda - processen är sannolik, trots allt - och när de fluorescerar förorenar de signalen från mitten. Dock, på grund av den olika tidpunkten för det spontana och stimulerade utsläppet, de tidigaste fotonerna som kommer till detektorn är från områden som belyses av den högsta STED -strålintensiteten, och de sista fotonerna som kommer är troligen från markörmolekyler som ligger på den centrala platsen. Så genom att vänta en kort tid (cirka en nanosekund) innan du spelar in bilden, de flesta fotonerna från den yttre ringen kan filtreras bort. Detta kallas "Time-gated STED Microscopy." Ytterligare skärpning av bilden uppnås genom en process som kallas deconvolution.
Uppfinningen av superupplöst mikroskopi innebar ett steg framåt inom biovetenskapen. Levande organismer kunde observeras med en aldrig tidigare skådad upplösning. Dock, time-lapse-sekvenser av bilder kunde inte göras över en anständig tid eftersom markörmolekylerna skulle brytas ned under den intensiva STED-strålen och sluta fluorescera. Detta är fotoblekningsproblemet. De skadade markörmolekylerna kan också bli giftiga för cellen.
Fotoblekningsproblemet löst
Shigehiro Yamaguchi och Masayasu Taki, vid Nagoya University Institute for Transformative Bio-Molecules (ITbM), ledde ett forskargrupp som har utvecklat en markörmolekyl, kallas "MitoPB Yellow, "som absorberas av mitokondriernas inre membran, inklusive cristae-de vikliknande strukturerna-och har en lång livslängd under en STED-stråle. Idén till markörmolekylen riktad mot mitokondrier kom från medförfattaren Chenguang Wang, av ITbM. Flerfärgad STED -avbildning med en enda STED -laser är också möjlig; och forskarna förväntar sig att fluorescerande markörer som liknar MitoPB Yellow bör hitta ett brett spektrum av tillämpningar även i andra superupplösningstekniker (t.ex. de som utvecklats av Eric Betzig och William Moerner).
För att demonstrera den praktiska användbarheten av MitoPB Yellow för levande cellbildning, gruppen placerade mitokondrier under förhållanden som är kända för att orsaka vissa strukturella förändringar - men hittills har dessa bara observerats med hjälp av transmissionselektronmikroskopi, som inte kan användas på levande celler. Mitokondrierna behandlades med ett reagens som undertrycker DNA -replikation, framkalla dysfunktion, för att observera deras överlevnad och döende processer.
Sedan, med Time-gated STED-mikroskopi, forskargruppen gjorde stillbilder med en upplösning på 60 nanometer (ungefär en tusendel av människohårets bredd), liksom tidsfördröjda bildsekvenser som visar mitokondrier som svarar på brist på näringsämnen genom att ändra form för att överleva. De långa bildsekvenserna - upp till 600 bilder - är de första som någonsin gjorts av mitokondrier vid den relativt höga rumsliga upplösningen på 90 nanometer. (Se video 1, som visar en time-lapse-sekvens inspelad över nästan 7 minuter.)
Under några minuter förändrades den inre mitokondriella strukturen dramatiskt på ett antal sätt. Initialt, förlängning och ökning av antalet cristae sågs. En bildsekvens (se figur 2a) visar inre membran i angränsande mitokondrier som smälter samman - med andra ord, två mitokondrier smälter ihop till en. En annan bildsekvens (se figur 2b) visar två cristae i en enda mitokondrion som tydligen smälter ihop. Förlängning och skapa mer cristae tros öka effektiviteten i energiproduktion (ATP -syntes) samtidigt som mitokondrium skyddas från "autofagosomal nedbrytning" - en programmerad död vars syfte är att ta bort onödiga eller dysfunktionella komponenter från cellen och möjliggöra ordnad nedbrytning och återvinning av cellulära komponenter.
Efter den första förlängningsperioden, de inre membranen i vissa mitokondrier delas upp i globuler som svällde och förlorade cristae (se film S2); några kulor sprack (film S4). Några bildade koncentriska sfärer (Figur 1 och Video 1). Fluorescensintensiteten förblev densamma. Anmärkningsvärt här är att cristae och membran förblir lika skarpt avbildade som tidigare, vilket indikerar att orsaken till mitokondrionens död inte är toxicitet på grund av nedbrytning av markörmolekylen under strålen. Den extremt starka STED -lasern kan ha skadat mitokondrierna, även om exakt varför de brister är okänt.
I dessa bilder, efter att ha sett de första överlevnadssvaren, vi tittar på mitokondriernas död under den intensiva STED -strålen. En framtida forskningsinriktning kommer att vara att minska intensiteten hos STED -laserstrålen genom att skapa en fluorescerande markörmolekyl som lyser när den belyses av ljus med längre våglängd och därmed lägre energi. Mitokondrier kan då leva längre.
Dock, även med MitoPB Yellow, den döende processen - som inte är väl förstådd - kan studeras. Ingen vet om de morfologiska (strukturella) förändringar som observerats under döende processen är relaterade till apoptos (normal, kontrollerad död) eller nekros (död på grund av skada eller funktionsstörning). Apoptos är känt för att utlösas av en signalmolekyl som kallas cytokrom C:om ett reagens kan hittas som undertrycker cytokrom C, då kunde mitokondrier - och mänskliga celler - leva längre.
Att kunna se processerna som sker i mitokondrier bör leda till ett bättre sätt att diagnostisera mänsklig mitokondriell sjukdom - och kanske till och med ett botemedel.