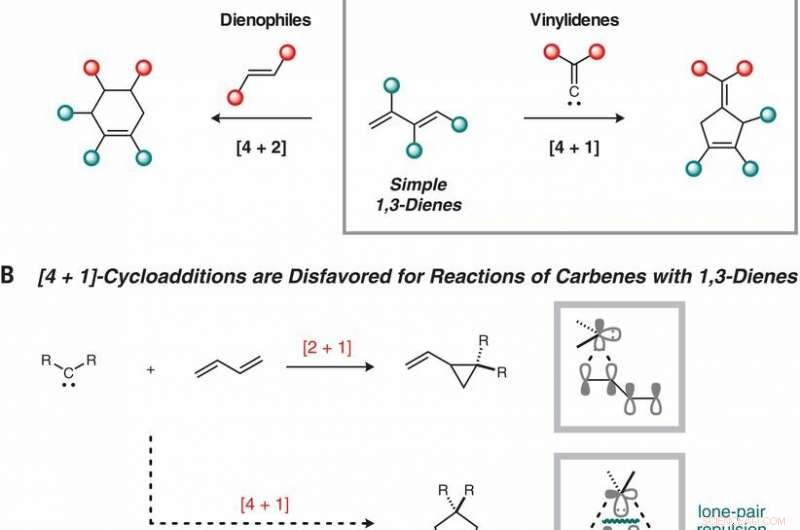
Reaktionsutveckling. (A) Kompletterande cykloadditionsvägar till fem- och sexledade ringar från 1, 3-diener. (B) Pericykliska [4 + 1]-cykloadditioner lider av stora elektroniska barriärer på grund av repulsion mellan det ensamma karbenparet och Ψ1-omloppsbanan i 1, 3-dien. (C) Dinickel-katalyserad reduktiv [4 + 1]-cykloaddition av 1, 1-dikloralkener och 1, 3-diener. NMP, N-metyl-2-pyrrolidon; rt, rumstemperatur; c-Pent, cyklopentyl. Kredit:(c) Vetenskap (2019). DOI:10.1126/science.aau0364
Ett par forskare vid Purdue University har hittat ett sätt att använda en diatomisk Ni-Ni-katalysator för att syntetisera cyklopentener. I deras papper publicerad i tidskriften Vetenskap , You-Yun Zhou och Christopher Uyeda beskriver sin metod och beskriver varför de tror att cyklopentenprodukter skulle vara användbara. Keywan Johnson och Daniel Weix med University of Wisconsin har publicerat ett Perspective-stycke i samma tidskriftsnummer som beskriver det arbete som gjorts av teamet i Indiana.
Johnson och Weix noterar att upptäckten av nya molekyler ligger bakom många av de nya material som forskare har skapat under åren. Ett av sätten som nya molekyler upptäcks är genom att observera dem i naturen och sedan syntetisera dem i ett labb. De noterar också att övergångsmetallkatalys har använts i stor utsträckning för att syntetisera många nya molekyler som för närvarande används i en mängd olika produkter. De noterar vidare att majoriteten av övergångsmetallkatalysen involverar användningen av bara en metallatom, men det har funnits undantag där katalysatorer har en tvåmetallatomkärna. I denna nya ansträngning, forskarna använde en diatomisk Ni-Ni-katalysator för att utföra stereokontrollerad syntes av cyklopentener (ringar gjorda av fem kolatomer).
Forskarna noterar att i typiska Diels-Alder-reaktioner, en dien och en alken tillåts reagera, vilket resulterar i en cyklohexen (en ring gjord av sex kolatomer). De noterar också att femledsringar tillverkas i naturen på en mängd olika sätt, vilket tyder på att de skulle kunna visa sig användbara om de lätt kunde syntetiseras. Tidigare försök att göra det, dock, har inte slagit ut. Problemet har handlat om [4 + 1] reaktioner - det finns svårigheter med att generera dem med hjälp av stabila molekyler. Också, reaktivitet med dem har visat sig vara en utmaning.
Zhou och Uyeda tog ett annat tillvägagångssätt, använda en tvåmetallkatalysator istället. De fann att i sitt tillvägagångssätt, de två metallkärnorna delade på uppgiften att kontrollera hur reaktionen skedde och att bilda karbenen. Detta möjliggjorde användningen av dikloralkener, som var mer stabila än diazoföreningar. Dessutom, bara ett av rodiumcentrumen var ansvarigt för bindningsbildningen med katalysatorn - det andra modulerade reaktiviteten hos det första genom bindningen. Resultatet blev en femsidig cyklopenten.
© 2019 Science X Network