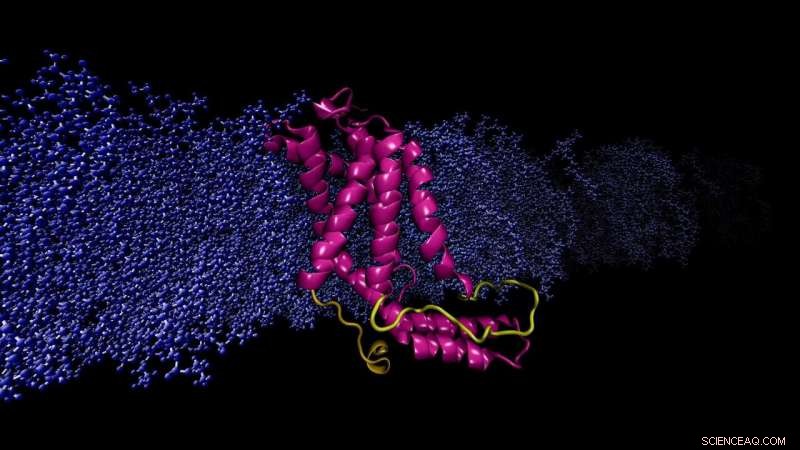
Beräkningsmodell YidC2 protein inbäddat cellmembran. Den modellerade slingan (gul), saknas i röntgenkristallstrukturen, är avgörande för stabilisering av protein. Upphovsman:Sogol Moradi
En ny studie av kemister vid University of Arkansas visar att röntgenkristallografi, standardmetoden för att bestämma strukturen hos proteiner, kan ge felaktig information om en kritisk uppsättning proteiner - de som finns i cellmembranen - vilket i sin tur kan leda till dålig och ineffektiv läkemedelsdesign.
Forskarnas resultat publicerades idag i Vetenskapliga rapporter , en Nature -publikation.
"Två tredjedelar av alla droger, inklusive de som används för kemoterapi, målproteiner som finns på cellmembranen, "sa Mahmoud Moradi, biträdande professor i kemi och biokemi vid J. William Fulbright College of Arts and Sciences. "Tyvärr, Röntgenkristallografi, guldstandarden för att bestämma strukturen hos proteiner, har många begränsningar när det gäller de som finns i cellmembranet. Vårt arbete avslöjar, och på många sätt, förklarar dessa begränsningar. "
Betraktade cellens arbetshästmolekyler, proteiner är ansvariga för nästan varje uppgift i levande system. Vissa proteiner lever inuti celler, och vissa ligger på cellens membran, ett yttre lager av lipider som separerar cellen från dess yttre miljö. Membranproteiner är kritiskt viktiga eftersom de reglerar utbytet av information och material mellan cellen och dess omgivning, en vital uppgift för överlevnad och cellens normala funktion eftersom alla störningar i proteinfunktionen kan leda till sjukdom.
Studien av proteinfunktion är nödvändig för att förstå den molekylära grunden för sjukdom. Att göra detta, forskare har förlitat sig på röntgenkristallografi, det primära verktyget för att bestämma proteinets form och struktur. Röntgenkristallografi är också avgörande för att utforma läkemedel som effektivt manipulerar proteiners funktion. Dock, studien av membranproteinstruktur är svår eftersom deras inhemska miljö inte är kompatibel med röntgenkristallografi. Forskare måste ta bort proteinerna från sin inhemska miljö och placera dem i en artificiell lipidmiljö innan de tillämpar tekniken.
Moradi och Thomas Harkey - en student vid den tiden och nu en medicinsk student vid University of Arkansas for Medical Sciences - tog upp detta problem från en annan vinkel. I ungefär två år har de använde en superdator på Arkansas High Performance Computing Center för att köra kontinuerligt, beräkningar på mikrosekundnivå som simulerar YidC2:s molekylära dynamik, ett membranprotein med en kristallografiskt olöst cytoplasmatisk slinga i dess molekylära struktur. Cytoplasmatiska öglor är kända för att ha funktionell betydelse i membranproteiner.
Moradi och Harkeys simuleringar visade att YidC2s cytoplasmatiska slinga stabiliserade hela proteinet, särskilt C1 -regionen, ett potentiellt viktigt område för läkemedelsdesign. Mycket polära eller laddade lipidhuvudgrupper interagerade med och stabiliserade öglan. Denna upptäckt visade att olösta slingor av membranproteiner kan vara viktiga för stabilisering av proteiner, trots den uppenbara bristen på molekylstruktur.
"Vanligtvis, om en del av ett protein inte löses i röntgenkristallografi, det tolkas som saknar en viss struktur, "Moradi sa." Vi visar att för membranproteiner och särskilt delar av proteinet som interagerar med cellmembranet, denna tolkning är inte korrekt och kan vara vilseledande. Vi tror att den alternativa förklaringen till sjukdomen kan vara att proteinet inte studeras i sin naturliga membranmiljö. "
Moradi sa att deras resultat också visade att beräkningskemi och superdatorteknik kan användas för att modellera membranproteiner mer exakt i en miljö som efterliknar deras fysiologiska miljö.