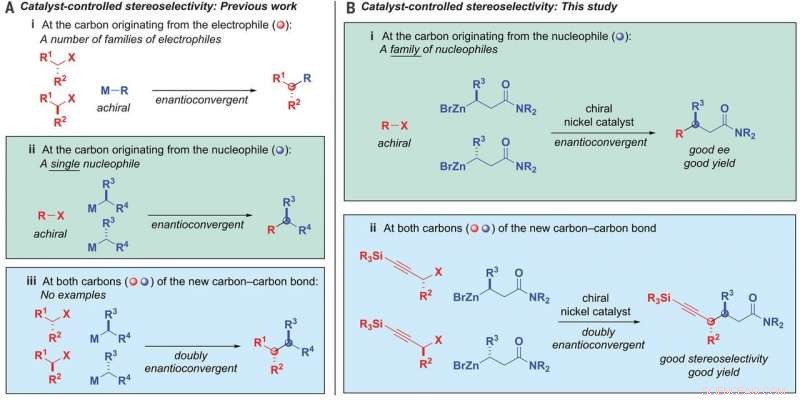
Alkyl-alkylbindningsbildning. (A) Katalysatorstyrd stereoselektivitet - tidigare arbete. (B) Katalysatorkontrollerad stereoselektivitet - denna studie. ee, enantiomert överskott; M, metall; R, substituent; X, lämnar gruppen. Kreditera: Vetenskap (2020). DOI:10.1126/science.aaz3855
Ett team av forskare vid California Institute of Technology har hittat en nickelkatalysator som binder alkylnukleofiler och alkylelektrofiler för att göra en enda stereoisomer med två kirala centra. I deras papper publicerad i tidskriften Vetenskap , gruppen beskriver sin process. Jianyu Xu och Mary Watson med University of Delaware har publicerat ett perspektiv på arbetet som gjorts av teamet i samma tidskriftsnummer.
I kemi, reaktioner som resulterar i material med kol-kolbindningar är önskvärda eftersom de används i storskaliga tillämpningar som läkemedel och jordbruksprodukter. Sådana reaktioner förlitar sig vanligtvis på övergångsmetallbaserade katalysatorer - men det finns begränsningar som hindrar många från att användas. Många arbetar bara med alkylföreningar, vilket kan leda till oönskade bireaktioner. Också, många sådana reaktioner resulterar i racemiska blandningar av produkter, vilket resulterar i ineffektivitet (racemiska blandningar är de som har lika stora mängder vänster- och högerhänta enantiomerer av en kiral molekyl).
Att länka racemiska blandningar av två alkyler samtidigt som man bibehåller kontroll av stereokemin i båda ändarna av produkten har historiskt sett ansetts vara mycket svårt. Men nu, som har förändrats, tack vare arbetet från teamet på CIT, och det har lett till en metod för att utföra reaktioner som leder till önskvärda kol-kolbundna material.
I sitt arbete, teamet utvecklade en nickelkatalysator som gör att en alkylnukleofil kan binda till en alkylelektrofil. I synnerhet, båda är racemiska kolföreningar. De använde en ligand som var tvåtandad - som gjorde att öppna fläckar på nickeln kunde binda till syret på nukleofilerna.
Reaktionen involverade också användningen av p-zinkerade amidnukleofiler och propargylhalogenidelektrofiler. Och det styrdes av katalysatorn. Genom att åsidosätta kiral information i båda startprodukterna och sedan återföra dem på ett fördefinierat sätt, kol-kol-bindningarna bildades. Resultatet var en enda stereoisomer som hade två kirala centra. Vid användning av nickelkatalysatorn, gruppen kopplade en racemisk blandning med nukleofiler och elektrofiler med upp till 95 procent stereoselektivitet och 82 procent utbyte. Testning visade också att den var kompatibel med 19 funktionella grupper.
© 2020 Science X Network