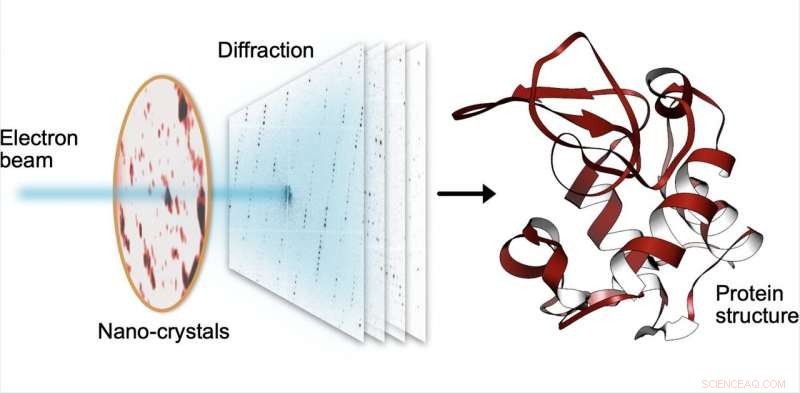
Vid seriell elektrondiffraktion, en liten elektronstråle träffar sekventiellt tusentals små kristaller gjorda av proteiner, som sprider strålen i diffraktionsmönster. Från dessa mönster, proteinernas struktur kan bestämmas med hög upplösning. Kredit:Robert Bücker
Förstå proteiners struktur, livets byggstenar, är väsentligt för att få insikt i deras biologiska funktion. På grund av deras minimala storlek och extrema bräcklighet, dessa strukturer är oerhört svåra att fastställa. Att skaffa data med tillräcklig upplösning kräver enorma doser av högenergiröntgenstrålning, vilket tyvärr oåterkalleligt skadar de proteiner som huvudsakligen undersöks.
Nu har forskare från MPSD och DESY i Hamburg utvecklat en ny uppfinningsrik metod som undviker dessa fallgropar och använder tillgängliga, kostnadseffektiv teknik. Deras arbete som beskriver den nya metoden har nu publicerats i Naturkommunikation .
I årtionden, forskare från många områden som fysik, biologi, och biokemi har lagt sin kreativitet i att kringgå problemet med strålningsskador. Nuvarande tillvägagångssätt inkluderar användningen av extremt korta och intensiva röntgenblixtar vid anläggningar som den nya europeiska röntgenfria elektronlasern (EuXFEL) i Hamburg, som kan ta välexponerade bilder av proteiner innan de bokstavligen får dem att explodera.
Även om denna metod har varit spektakulärt framgångsrik för att erhålla högupplösta proteinstrukturer, generering av röntgenstrålar med den erforderliga ljusstyrkan kräver användning av stora och dyra partikelacceleratorer. Ett mycket effektivt alternativ, som praktiseras intensivt vid Centre for Structual Systems Biology (CSSB) i Hamburg, till exempel, är att helt avstå från röntgenstrålar, och använd elektronstrålar istället, som är skonsammare mot de känsliga biomolekylerna och lättare att generera.

En slowmotion-film där diffraktionsmönster (vänster) samlas in från tusentals små kristaller (höger) i ett elektronmikroskop. Kredit:Robert Bücker
MPSD/DESY-forskarteamet vid Center for Free-Electron Laser Science (CFEL) har på ett genialiskt sätt kombinerat sådana metoder med big data computing och senaste förbättringar inom kamerateknologi och lyckats få högupplösta proteinstrukturer från relativt lättillgängliga nanokristaller. För att uppnå detta, de har utvecklat en teknik som kallas seriell elektrondiffraktion genom att anpassa experimentella metoder som redan är kända inom röntgenkristallografigemenskapen för att sekventiellt förvärva och bearbeta diffraktionsmönster från tusentals kristaller.
Istället för att använda ett instrument för miljarder euro som EuXFEL, de fördelade helt enkelt dessa kristaller på en tunn kolfilm och satte in dem i ett transmissionselektronmikroskop, en överallt tillgänglig enhet. Elektronstrålen görs att hoppa från en nanokristall till nästa för att erhålla diffraktionsdata. Förutom materialbesparingar på ofta sällsynta och kostsamma prover, Att använda nanokristaller innebär att forskare inte längre behöver odla stora proteinkristaller som krävs av äldre (röntgen)metoder – ett åtagande som ofta visar sig vara oöverkomligt svårt.
För att kringgå skadan som orsakas av elektronstrålen, istället för att bara ta ett enda foto, en kort film spelas in med en höghastighetskamera medan elektronstrålen vilar på varje kristall. I filmen, man kan bokstavligen se proteinerna i kristallen "smälta bort" - dock det finns tillräckligt med information i den här filmen om diffraktion under förstörelse för att rekonstruera data nästan som om det inte var någon skada alls. Denna procedur upprepas för tusentals nanokristaller, och inom några timmar, med hjälp av specialiserad programvara utvecklad på DESY, den enorma mängden data omvandlas till en högupplöst proteinstruktur.
Förutom proteiner och andra biomolekyler, seriell elektrondiffraktion är också tillämplig på många klasser av nya funktionella material, såsom perovskiter och metallorganiska ramverk – alla är de lovande kandidater för framtida tillämpningar inom solceller och vätelagring. Forskargruppen är entusiastiska över den lätta att använda denna innovativa teknik, med sina låga utrustningskrav och breda användbarhet. De räknar med att det kommer att spridas från MPSD till laboratorier över hela världen.