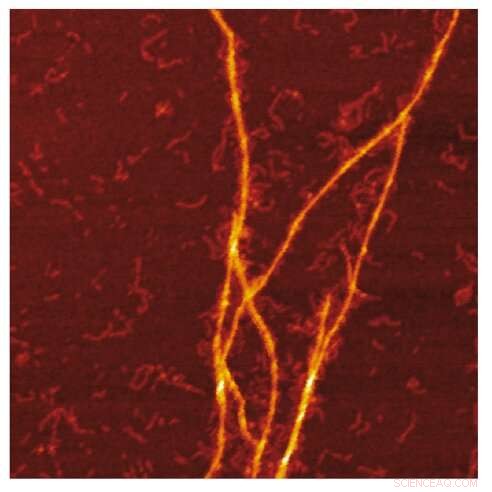
AFM-bild av amyloidmallen av S100A9-fibriller på ytan av Aβ-fibriller. Kredit:Jonathan Pansieri
En forskargrupp ledd av Ludmilla Morozova Roche vid Umeå universitet, Sverige, har gett den mekanistiska insikten om proteinsamaggregation vid Alzheimers sjukdom. Mallmekanismen för S100A9 amyloider på Aβ fibrillära ytor under samaggregationsprocessen avslöjades genom synergi av biofysiska metoder inklusive laddningsdetektering masspektrometri, mikroskopi, kinetiska och mikrofluidiska analyser.
Amyloidbildning är av den centrala kliniska betydelsen eftersom denna process är involverad i många neurodegenerativa sjukdomar som Alzheimers, Parkinsons och andra. Dessa sjukdomar påverkar miljontals av den åldrande befolkningen över hela världen. Ofta är det svårt att dra gränsen mellan dessa sjukdomar eller så kan de uppstå samtidigt, vilket är känt som sjukdomskomorbiditet.
Medan amyloidbildningsprocessen studerades omfattande, lite är känt om de specifika mekanismerna för samaggregering av olika amyloidarter tillsammans, bakomliggande sjukdomarnas samsjuklighet. Vid Alzheimers sjukdom, den amyloid-neuroinflammatoriska kaskaden manifesteras i samaggregation av Aβ med proinflammatoriskt S100A9-protein, vilket leder till intracellulär och extracellulär amyloidsammansättning, amyloidplackavsättningar och cellulär toxicitet.
Att dechiffrera interaktionerna mellan proinflammatoriskt S100A9-protein och Aβ42-peptid vid Alzheimers sjukdom är grundläggande eftersom inflammation spelar en central roll i sjukdomsuppkomsten. Här använder forskarna innovativ laddningsdetektionsmasspektrometri (CDMS) tillsammans med biofysikaliska tekniker för att ge mekanistisk insikt i samaggregationsprocessen och differentiera amyloidkomplex på en enda partikelnivå.
Kombination av mass- och laddningsfördelningar av amyloider tillsammans med rekonstruktion av skillnaderna mellan dem och detaljerad mikroskopi avslöjar att samaggregation involverar schablonläggning av S100A9-fibriller på ytan av Aβ42-amyloider. Kinetisk analys bekräftar ytterligare att de ytor som är tillgängliga för Aβ42 sekundär kärnbildning är förminskade på grund av beläggning av S100A9 amyloider, medan bindningen av S100A9 till Aβ42-fibriller valideras med en mikrofuidisk analys.
Forskarna visar att synergi mellan CDMS, mikroskopi, kinetiska och mikrofuidiska analyser öppnar nya riktningar inom tvärvetenskaplig forskning.