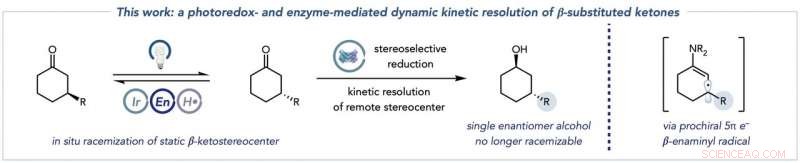
Den övergripande transformationen som kombinerar racemisering av ketonsubstraten (vänster) med biokatalytisk reduktion till enantiomeriskt rena alkoholprodukter (mitten), och de viktigaste enaminylradikalarterna som denna kemi låser upp för att möjliggöra racemisering av typiskt statiska β-ketostereocentrar (höger). Kredit:Jacob DeHovitz
Ett samarbete mellan två labb vid Princeton Universitys Department of Chemistry har gett en slående ny plattform som gör det möjligt för kemister att omtolka reglerna för stereokemi och stereokontroll med viktiga konsekvenser för läkemedels- och agrokemisk industri.
Forskningen visar förmågan hos fotoredoxkatalys att ta traditionellt statiska stereocentra och göra dem dynamiska genom att kontinuerligt och kontrollerbart bryta och återbilda molekylära bindningar. Det visar ett löfte för forskare att sätta stereocentren för en komplex målförening i korthet, effektivt steg snarare än ett stereocenter åt gången. (Ett stereocenter ger en molekyl spegelbildsasymmetri, vilket är viktigt för att bestämma biologiskt aktiva egenskaper under syntes.)
Samarbetet parar expertis från MacMillan-labbet och Hyster-labbet. Pappret, "Statisk till inducerbart dynamisk stereokontroll:den konvergenta användningen av racemiska β-substituerade ketoner, " dyker upp i Vetenskap Denna vecka.
"I vanliga fall, när du funderar på att bygga molekyler med stereocentrar i, du funderar på att sätta stereocentrum i den bindningsbildande händelsen, sa Todd Hyster, biträdande professor i kemi. "Och vad vi har funnit är att om du använder fotoredoxkatalys, du kan i princip låsa upp mekanismer för att göra stereocentrar som annars skulle vara statiska, eller fast. Du kan göra dem dynamiska.
"När du kopplar ihop dem med mycket selektiva enzymer, du kan tänka på att bygga stereokemiskt komplexa molekyler på helt nya sätt."
Stereokemi innefattar det rumsliga arrangemanget av atomer och hur de kan manipuleras i molekylstrukturen för önskade resultat. Det härrör från det faktum att kol har fyra substituenter. Dessa fyra substituenter är olika; de måste existera som spegelbilder av varandra. Dessa spegelbilder kallas enantiomerer. Våra händer är enantiomerer, till exempel; de är spegelbilder av varandra. Vad det praktiskt betyder är att de inte kan läggas ovanpå - en vänsterhandske passar inte på en högerhand.
Människokroppen reagerar på mediciner på exakt samma sätt. Vår biologiska materia består av en serie spegelbilder och inte av den andra. Kroppen kan känna igen skillnaden mellan två läkemedel som verkar identiska trots att den ena är en spegelbild och den andra inte är det. Det erkännandet påverkar upptaget och därmed effekten av terapier.
Vad MacMillan och Hyster -forskningen avslöjade är ett sätt att koppla bort stereocentrets konfiguration från steget där det bildas, eller racemiserad. Att kunna kontrollera denna rasemisering är viktigt för utvecklingen av de mest effektiva läkemedlen.
"Det är många, många anledningar till att detta är spännande forskning, inte minst kan du i grunden skapa en molekyl och du kan säga, kanske skulle jag verkligen vilja ändra det stereocentret för att göra det till något annat. Du kan faktiskt gå tillbaka och göra det, sa David MacMillan, James S. McDonnell Distinguished University Professor of Kemi. "Det här är något som vi inte tror har gjorts på det här sättet tidigare inom organisk kemi och så öppnar det upp några anmärkningsvärda möjligheter."
Enzymer ökar resultaten
Det var införandet av mycket selektiva enzymer i processen som drev undersökningens framsteg från "B+ till A+"-forskning, sa MacMillan.
"Enzymer har det här sättet att kunna ge det som kallas stereokontroll, eller införa mycket specifika former för att göra kemi som vanliga katalysatorer bara inte kan göra, " sa han. "Genom att föra samman dessa två idéer, det tillåter ett helt nytt förhållningssätt till hur du bygger stereokemi."
Det händer mycket under huven i den här processen. När forskare syntetiserar en förening med flera stereocentra, de gör antagandet att centrum inte kan vända eller bli dynamiskt när det väl är "inställt". Molekyler syntetiseras sekventiellt:ett centrum bildas, och sedan är det låst; och sedan bildas en annan, och sedan är det låst, och så vidare.
Jacob DeHovitz, en femteårs doktorand i Hyster-labbet och huvudförfattare på tidningen, förklarade hur reaktionen som beskrivs i denna forskning gör det möjligt för forskare att låsa upp den inställningen.
Det finns två viktiga delar i reaktionen. I första halvlek, två nyckeltyper bildas från ett ketonutgångsmaterial. Den första arten kallas enamin, nyckeln eftersom den kan riktas mot fotoredox-katalysatorn. En andra art - en enaminylradikal - härrör från det steget, och förstör det ursprungliga molekylära stereocentret och sätter upp nästa steg i processen.
"Den andra halvan är den biokatalytiska reaktionen. Enzymet i lösning - i detta fall främst ketoreduktaser - reducerar en av dessa ketonenantiomerer, som återigen ständigt racemiserar i lösning, att bilda en alkoholprodukt som inte kan genomgå racemisering under våra förhållanden. Kritiskt, den andra ketonenantiomeren reagerar inte med ketoreduktaset eftersom den inte kan passa in i det aktiva stället för enzymet. Denna förspänning för en enantiomer är viktig eftersom den förhindrar ketoreduktaset från den oönskade bildningen av andra alkoholstereoisomerer.
"Om den biokatalytiska reaktionen kombineras med de nya racemiseringsförhållandena där utgångsmaterialets enantiomerer ständigt racemiserar, då kan en kemist teoretiskt ha råd med upp till 100 % av den önskade produkten, fördubbla effektiviteten, " sa DeHovitz.
Denna forskning representerar tre års samarbetsundersökning av de två labben.