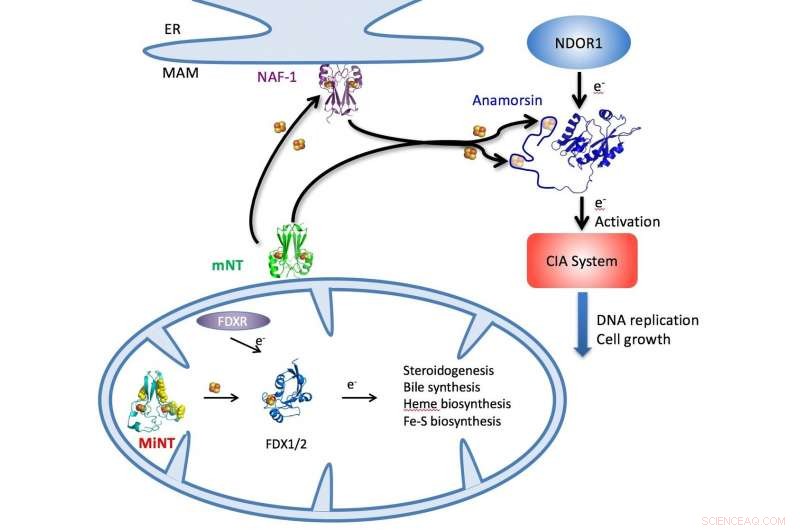
En illustration beskriver NEET-cykeln i celler genom vilka järn-svavelkluster levereras av MiNT, mitoNEET (mNT) och NAF-1 proteiner i cytosolen eller mitokondrierna (botten) till en rad cellulära metaboliska processer, inklusive syntesen av ATP. Upphovsman:Patricia Jennings/University of California i San Diego
Ett tvåfasat protein i en kedja som reglerar järn och andra element i celler kan ge ett nytt mål för behandling av cancer, diabetes och andra sjukdomar.
Ett team av forskare vid Rice University, University of California i San Diego (UCSD), hebreiska universitetet i Jerusalem och University of North Texas detaljerade strukturen för ett protein som kallas mitokondriellt inre NEET (MiNT), del av en väg som stabiliserar mitokondrier, organellerna som producerar energi till cellerna.
Deras rapport visas denna vecka i Förfaranden från National Academy of Sciences .
MiNT skiljer sig från sina kusiner, NEET-proteinerna mitoNEET och NAF-1, men de spelar alla en roll i utvecklingen av cancer, diabetes, neurodegenerativa sjukdomar och åldrande. NEET -proteiner har varit i fokus för teamet som tidigare rapporterat deras betydelse för att binda giftiga kluster av järn och svavel i celler och som ett möjligt mål för att behandla bröstcancer.
I den nya studien, forskarna under ledning av mångåriga samarbetspartners Patricia Jennings vid UCSD och José Onuchic vid Rices Center for Theoretical Biological Physics (CTBP) blev de första som redogjorde för den kristallina strukturen hos MiNT, även känd som CISD3, som ligger inuti mitokondrier.
Jennings och hennes team producerade molekylstrukturen. Med det, de kunde visa att medan MiNT delar vissa egenskaper med andra järn-svavelproteiner i NEET-familjen, det finns betydande skillnader som sannolikt gör den till den mest kraftfulla av de tre.
MitoNEET och NAF-1 (aka CISD1 och CISD2, respektive) är dimerer, proteiner med två liknande, anslutna monomerer som finns i cytosolen, vätskan inuti cellerna. Men MiNT är en monomer som uteslutande lever inuti mitokondrier, där den samlar järn-svavelkluster som levereras av de andra NEET:erna och distribuerar dem för att underlätta, bland annat, syntesen av adenosintrifosfat (ATP), molekylen som bär energi genom cellerna för att möjliggöra metaboliska processer.
MiNT skiljer sig också genom att visa två sidor till sin miljö, en hydrofob (vattenavstötande) och den andra hydrofil (vattenattraktiv). "Eftersom det är en monomer, varje sida är olika, så det kommer att interagera med olika proteiner, och du kanske kan rikta in det med olika läkemedel på varje sida, "sa Jennings, en CTBP -affiliate och en professor i kemi och biokemi vid UCSD.
"Det är snabbare och mer effektivt än de andra NEET:erna, "sa Onuchic, vars labb byggde datasimuleringar för att studera MiNTs vikningsdynamik. "Det skulle vara mycket farligt att ha ett sådant protein i cytosolen;
det är därför det är begränsat inuti mitokondrier, där många bioenergetiska processer äger rum. "
Forskarna sa att MiNT är viktigt för balansen mellan järn och reaktiva syrearter (ROS) i mitokondrier. "Järn är giftigt, "Jennings sa." För mycket av det i cellen är dåligt. Vi måste därför kontrollera det i våra kroppar eftersom det är så viktigt för energireglering och nyckeln till hälsa och sjukdomar.
"Med strukturen hos MiNT, vi kan börja förstå den fullständiga regleringsslingan som styr järn-svavelkluster och ROS som inte kände igen tidigare, "sa hon." Vi kan börja se hur dessa proteiner reglerar flödet in och ut ur mitokondrierna. "
MiNT:s roll i ATP -produktion kan göra det till ett effektivt mål för krympande tumörer, Sa Onuchic. Tidigare experiment med de andra NEET:erna visade nedreglering av deras uttryck eller inriktning på deras centra minskade mängden energi som finns tillgänglig för cancerceller, vilket minskar tumörtillväxten.
"Cancerceller behöver så mycket mer järn än friska celler med normal järnhomeostas, "sa han." När en cell delar sig, det måste fördubbla ribosomerna, och det är energiskt mycket dyrt. Eftersom cancerceller delar sig så snabbt, de behöver mycket mer järn och är beroende av NEET -cykeln för att tillhandahålla det.
"Cancer använder de tre NEET -proteinerna eftersom de kräver så mycket järn och reaktivt syre, "Onuchic sa." Det vi har märkt - även om det inte är klart exakt hur de fungerar - är att om du slår ner någon av dem, det får tumörer att växa sig mindre. Även om du slår ner bara en, Det minskar cancertillväxten. "Eftersom MiNT är en mer underbar tillverkare av järn och ROS, det kan vara det mest effektiva av de tre att rikta in sig på, han sa.
"Upptäckten av MiNT -strukturen, dynamik och engagemang i mitokondriellt järn och ROS -ackumulering möjliggjorde karakterisering av hela NEET -proteinfamiljen, "sa medförfattaren Rachel Nechushtai, professor vid hebreiska universitetet i Jerusalem. "Dessutom, det ger vårt internationella team den unika möjligheten att reda ut de tre NEET -proteinernas inbördes samband och upptäcka i vilka mobilvägar de är involverade.
"Upptäckten att alla tre järn-svavelproteiner samarbetar i samma väg för att skydda cancerceller ger en utmärkt uppsättning mål för cancerterapi, " Hon sa.
"Länken som NEET -proteiner ger mellan järnhalter i cancerceller och nivån av reaktiva syrearter visar hur cancerceller kontrollerar balansen mellan en hög proliferation och mutationer, som är nyckeln till vår förståelse för hur man bekämpar cancer, "sa medförfattaren Ron Mittler, professor i biologi vid University of North Texas.