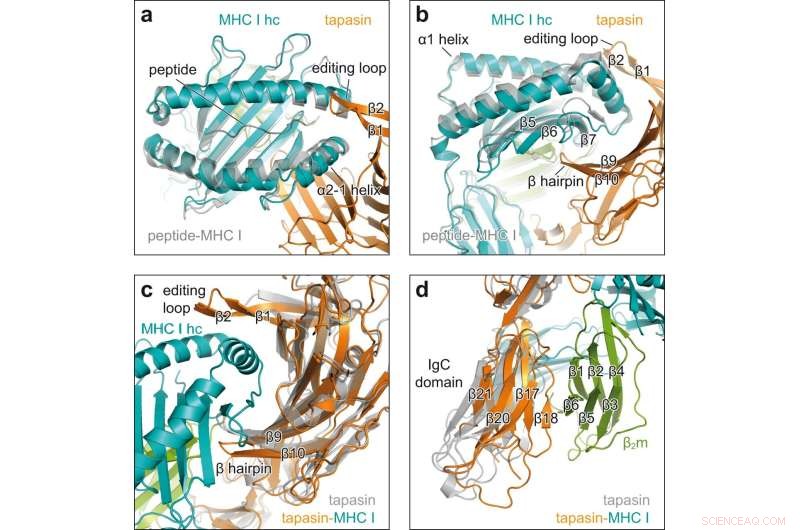
Konformationsförändringar vid engagemang för klient och chaperone. en ovanifrån av överlagring av peptidreceptiv MHC I i chaperonkomplexet (MHC I hc, teal; tapasin, orange) med peptidbunden H2-D b (grå, PDB ID 2F74) i tecknad representation. hc tung kedja; β1, β2, β strängar av redigeringsslinga av tapasin. b Sidovy av superpositionen som visas i en β5, β6, β7, β strängar av MHC I hc; β9, β10, β hårnål av tapasin. c Se på det konkava gränssnittet för tapasin i superposition av MHC I-bundet tapasin från chaperonkomplexet (tapasin, orange; MHC I hc, blågrönt; β2m, grönt) med klientfritt tapasin (grå, PDB ID 3F8U). d Superposition som i c men sett på den C-terminala domänen av tapasin. IgC-domänens konstanta immunoglobulindomän, β2 m β2 -mikroglobulin. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-32841-9
Som arbetsstyrkor för det adaptiva immunsystemet är T-lymfocyter ansvariga för att attackera och döda infekterade eller cancerceller. Sådana celler, som nästan alla celler i människokroppen, presenterar på sin yta fragment av alla proteiner de producerar inuti. Om dessa inkluderar peptider som en T-lymfocyt känner igen som främmande, aktiveras lymfocyten och dödar cellen i fråga.
Det är därför viktigt för ett robust T-cellssvar att lämpliga proteinfragment presenteras för T-lymfocyten. Forskargruppen ledd av Simon Trowitzsch och Robert Tampé från Institute of Biochemistry vid Goethe University Frankfurt har nu belyst hur cellen väljer dessa proteinfragment eller peptider.
Peptidpresentation sker på så kallade major histocompatibility complex class I molekyler (MHC I). MHC I-molekyler är en grupp mycket olika ytproteiner som kan binda myriader av olika peptider. De är förankrade i cellmembranet och bildar en peptidbindande ficka med sin utåtvända del.
Liksom alla ytproteiner tar MHC I-molekyler den så kallade sekretoriska vägen:de syntetiseras in i cellens kavitetssystem (endoplasmatiskt retikulum (ER) och Golgi-apparaten) och viks där. Små vesiklar knoppar sedan av från kavitetssystemet, migrerar till cellmembranet och smälter samman med det.
Mognadsprocessen för MHC I-molekylerna är mycket strikt kontrollerad:i ER hjälper proteiner som kallas "chaperones" dem att vikas. Chaperonetapasinet är väsentligt för peptidladdning i denna process.
"När en MHC I-molekyl har bundit en peptid, kontrollerar tapasin hur tät bindningen är", säger Trowitzsch och förklarar chaperonens uppgift. "Om bindningen är instabil, tas peptiden bort och ersätts av en tätt bindande." Det har dock ännu inte varit möjligt att klargöra hur exakt tapasin utför denna uppgift – särskilt eftersom laddningsprocessen är extremt snabb.
Biokemisterna och strukturbiologerna från Goethe-universitetet i Frankfurt har nu för första gången lyckats visualisera den kortlivade interaktionen mellan chaperone och MHC I-molekylen med hjälp av röntgenstrukturanalys.
För att göra detta producerade de varianter av de två interaktionspartnerna som inte längre var inbäddade i membranet, renade dem och förde dem samman. Ett knep hjälpte till att fånga laddningskomplexet i aktion för kristallisering:först laddade forskargruppen MHC I-molekylen med en högaffinitetspeptid så att ett stabilt komplex skapades.
En ljussignal utlöste klyvning av peptiden, vilket kraftigt minskade dess förmåga att binda MHC I-molekylen. Omedelbart kom tapasin in på scenen och förblev bundet till MHC I-molekylen som saknar sin peptid. "Den fotoinducerade klyvningen av peptiden var avgörande för framgången för vårt experiment", säger Tampé. "Med hjälp av denna optokemiska biologi kan vi nu systematiskt reproducera komplexa cellulära processer en efter en."
Röntgenstrukturanalys av kristallerna avslöjade hur tapasin vidgar den peptidbindande fickan i MHC I-molekylen och därigenom testade styrkan hos peptidbindningen. För detta ändamål bildar interaktionspartnerna en stor kontaktyta; för stabilisering sitter en ögla av tapasin ovanpå den vidgade bindningsfickan.
"Det här är första gången vi har visat processen att ladda med hög upplösning", säger Tampé. Bilderna avslöjar också hur en enda chaperone kan interagera med den enorma mångfalden av MHC I-molekyler, säger biokemisten. "Tapasin binder exakt de icke-variabla regionerna av MHC I-molekylerna." Den nya strukturen förbättrar dock inte bara vår förståelse för de komplexa processer som är involverade i att ladda MHC I-molekyler. Det bör också hjälpa till att välja ut lämpliga kandidater för vaccinutveckling.
Forskningen publicerades i Nature Communications . + Utforska vidare