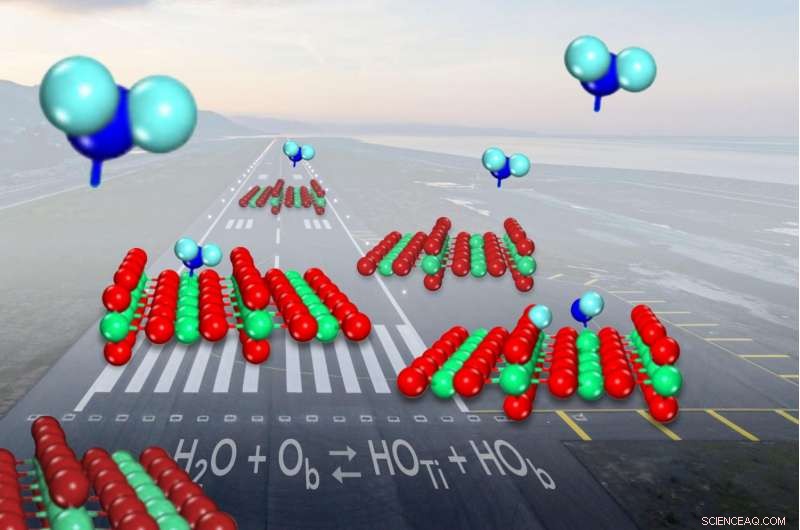
När vatten (visas i blått) kommer in för en landning på den vanliga katalysatorn titanoxid (visas i rött och grönt), den delar sig i hydroxyler (på vänster sida) strax under halva tiden. Upphovsman:Zdenek Dohnalek
När en molekyl vatten kommer in för en landning på den vanliga katalysatorn titanoxid, det bryts ibland upp och bildar ett par molekylfragment som kallas hydroxyler. Men forskare hade inte kunnat visa hur ofta uppbrottet skedde. Nu, forskare har fastställt att vatten bara är lite mer sannolikt att stanna i ett stycke eftersom det binder till katalysatorytan än det är att bilda hydroxylpar.
Resultatet - vattnets fördel är så liten - kan överraska vissa kemister. Men att förstå att den lilla fördelen har stor betydelse för en mängd olika potentiella tillämpningar i branscher som använder titandioxid. Dessa branscher inkluderar alternativ bränsleproduktion, solenergi och livsmedelssäkerhet, och till och med självrengörande fönster. Det kommer också att hjälpa forskare att bättre förstå hur syror beter sig och utöka sin kunskap om hur molekyler splittras.
"Hur vatten binder var den stora frågan, "sa kemisten Zdenek Dohnalek vid Department of Energy's Pacific Northwest National Laboratory." Kemister hade blandad information från många olika metoder, och teoretiker hade också idéer. Med en unik kombination av instrument, vi har äntligen löst det. "
Teamet rapporterade arbetet i Förfaranden från National Academy of Sciences .
Mysteriets land
Även om många industrier använder titanoxid för att påskynda kemiska reaktioner, forskare har inte avslöjat alla dess hemligheter. Ett viktigt mysterium, forskare har länge diskuterat, är det sätt på vilket vatten interagerar med titanoxid. Samspelet är viktigt i sig för att dela vatten, men det påverkar också loppet av många reaktioner i allmänhet.
På ytan av titanoxid, vattenmolekyler växlar mellan att vara intakta och dela upp sig i hydroxyler. Även om det finns många olika sätt att mäta förhållandet mellan intakt vatten och hydroxyler vid varje given tidpunkt, forskare har inte kunnat spika ner det på decennier.
För att utforska problemet, PNNL -forskare kombinerade olika verktyg på ett nytt sätt. De skickade vattenstrålar med olika hastigheter till kallt titanoxid som satt under ett mycket högupplöst mikroskop som kallas ett skannande tunnelmikroskop.
Mikroskopet låter dem visualisera katalysatorns titan- och syreatomer. Atomerna visas som ljusa och mörka rader, som ett sädesfält med höga majsrader omväxlande med diken, och enskilda vattenmolekyler framstår som ljuspunkter som inte ligger i linje med raderna.
Förutom att se vattenmolekyler när de träffar ytan, laget simulerade detaljer om atomerna som interagerade i exakta detaljer på en högpresterande dator. Genom att kombinera experiment och simuleringar kunde teamet lösa den långvariga debatten.
Omedelbar attraktion
Formad som ett V, en vattenmolekyl har en fettsyreatom i mitten bunden till två mindre väteatomer på vardera sidan. Titanoxid hjälper till att bryta bindningarna mellan atomerna för att driva en kemisk reaktion framåt:titanatomerna fäller vattenmolekyler, medan närliggande oxygens, också en del av katalysatorytan, drar bort och fångar upp en av väteatomerna.
När detta händer, två hydroxyler bildas, den ena från en ytsyre som kombineras med vätet och den andra som är kvar från vattenmolekylen.
Forskarna behövde veta hur ofta hydroxylerna bildades. Förblir vattenmolekylerna i stort sett intakta på ytan? Eller konverterar de omedelbart till hydroxyler? Hur troligt att vatten kommer att förbli intakt på titanoxid - och hur lätt hydroxylerna omvandlas till vatten - sätter scenen för andra kemiska reaktioner.
Att få reda på, kemisterna var tvungna att utveckla teknik för att mäta hur ofta hydroxylerna uppstod på ytan. Med hjälp av resurser som utvecklats inom EMSL, Environmental Molecular Sciences Laboratory, en DOE Office of Science User Facility på PNNL, de sköt en stråle vattenmolekyler mot en titanoxidyta med låg energi - strålen skjöt långsamt, och med hög energi - rör sig snabbt som ur en eldslang.
De slutade med ljuspunkter på ytan, och ju högre energi, desto fler fläckar. Men fläckarna såg inte tillräckligt ljusa ut för att inkludera båda hydroxylerna, som förväntat, så de utförde ytterligare experiment för att avgöra vad fläckarna var.
Exakt
Teamet sköt vatten på titandioxidytan och frös sedan vattnet på plats. Sedan värmde de långsamt upp allt. Höjning av temperaturen avslöjade fläckarna - som de trodde var minst en hydroxyl - som förvandlades till vattenmolekyler. Detta innebar att varje plats faktiskt måste vara ett par hydroxyler eftersom bevisen visade att alla råvaror som behövs för att göra en vattenmolekyl satt där, och båda hydroxylerna behövdes.
De utförde olika andra experiment för att bestämma temperaturen vid vilken en landningsvattenmolekyl omvandlas till hydroxylpar och vice versa. Därav fick de veta att vattnet bara är något mer stabilt än hydroxylparen på ytan - 10 procent mer, om vi går efter mängden energi som krävs för att störa dem.
Simulera vattenlandningarna på en högpresterande dator, även på EMSL, forskarna fick reda på att de enda vattenmolekylerna som fastnade vid katalysatorn var de som landade i ett figurativt dike i ett majsfält, där vattnets syre möter en titanatom nere i diket.
Om vattnet kom in med precis rätt hastighet, vattnet omorienterade och lade ett av dess väte mot ett närliggande syre, bildar hydroxylpar som ses i experimenten. Om inte, vattenmolekylen studsade bara av.
"Vi upptäckte att elektrostatik - samma statik som ger gnistor när du gnuggar fötterna på mattan - hjälpte till att styra vattenmolekylerna på ytan, "sa den teoretiska kemisten och medförfattaren Roger Rousseau.
Alla dessa detaljer hjälper forskare att förstå katalys bättre och förbättra vår förståelse av kemiska reaktioner. Dessutom, resultaten visar ett värde som forskare länge har försökt spika fast - hur lätt eller svårt det är för vatten att tappa väte på titanoxid.