HS-AFM-bilder av cadherin-dimererna visas överst. Bindningsmekanismen för cadheriner illustreras längst ner baserat på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi från forskare vid Exploratory Research Centre on Life and Living Systems (ExCELLS)
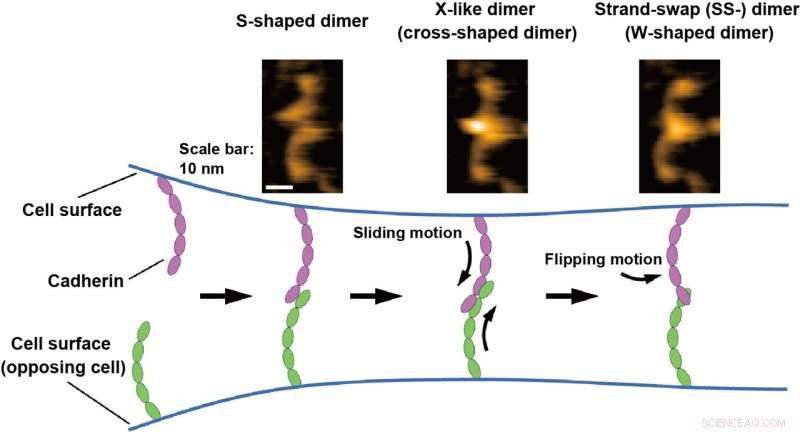
Cell-, vävnads- och organstruktur upprätthålls av cell-celladhesionsmolekyler som kopplar samman motstående celler. Cadheriner är en klass av essentiella cell-celladhesionsmolekyler för vävnadsbildning och integritet, och defekter i cadherinfunktionen orsakar olika sjukdomar (t.ex. cancerinvasion). Cadherin sticker ut från cellytan och binder ett annat cadherin på en motstående cell för att mediera cell-celladhesion. Cadherinbindningsprocessen omfattar huvudsakligen två dimeriseringssteg:X-dimerbildning och strängbyte (SS-) dimerbildning av de extracellulära domänerna (ektodomäner) av cadherin. Emellertid har andra interaktioner än de som involverar bildandet av X- och SS-dimererna också föreslagits, och den exakta bindningsmekanismen för cadherin är fortfarande kontroversiell.
Shigetaka Nishiguchi från ExCELLS, Takayuki Uchihashi från ExCELLS och Nagoya University och Tadaomi Furuta från Tokyo Tech tillämpade höghastighets atomkraftsmikroskopi (HS-AFM) för att utforska bindningsmekanismen för cadheriner. HS-AFM kan möjliggöra visualisering av enkelmolekylära strukturer och dynamik i lösning på nanometerskala med subsekunders tidsupplösning genom att direkt beröra och skanna ytan av proteiner genom en skarpspetsad sond. HS-AFM avslöjade att cadheriner existerade som multipla dimera strukturer, som baserat på deras morfologi kan klassificeras som W-, kors- och S-formade dimerer.
Vidare genomförde forskarna mutations- och strukturmodelleringsanalyser och fann att W- och korsformade dimerer motsvarade kända SS-dimerer och X-liknande dimerer och att den S-formade dimeren är en ny konformation. Bindningsprocesserna för cadheriner som direkt visualiseras av HS-AFM avslöjade också att dimeriseringsprocessen avslutas inom en sekund genom omvandling till de ovannämnda tre typerna av dimera strukturer. Baserat på dessa HS-AFM-observationer, antog forskarna att bindningsmekanismen fortskrider genom glidrörelsen hos den S-formade dimeren följt av vändningsrörelsen hos X-dimeren för att bilda SS-dimeren, som tros vara den sista stabil cadherindimer.
Hittills har bindningsmekanismen för cadheriner huvudsakligen undersökts med hjälp av strukturella analyser och cell- och lösningsmätningar, som endast kan analysera de bindningstillstånd som reflekteras av det stora antalet cadheriner. Den nyligen tillämpade HS-AFM-tekniken avslöjade bindningsprocesserna för individuella cadheriner vid en molekylupplösning, vilket inte har uppnåtts tidigare. HS-AFM-observation kommer att bana väg för en djupare förståelse av bindningsmekanismen för cadheriner, vilket är viktigt för vävnads- och organ-nivåorganisation och cell-celladhesionsrelaterade sjukdomar.
Forskningen publicerades i Proceedings of the National Academy of Sciences . + Utforska vidare