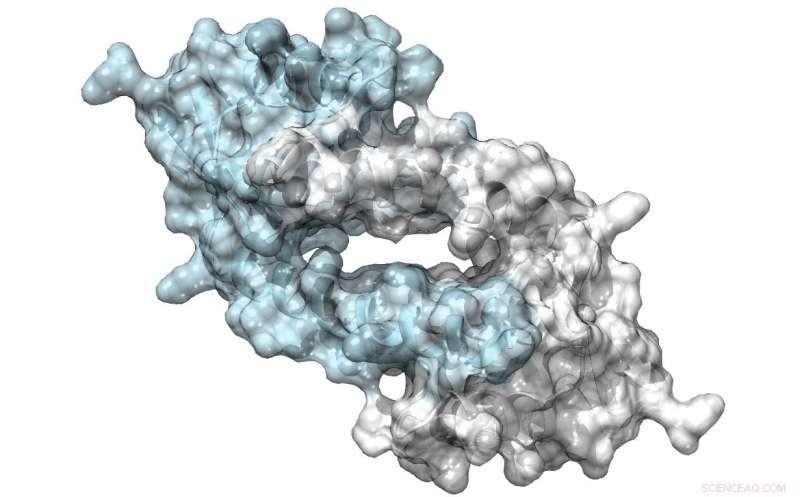
Struktur för LmrR, ett protein med en stor por vid dess dimergränssnitt, som kan binda antibiotika eller rekrytera substrat för att genomgå katalys. Kredit:Clemens Mayer / University of Groningen
Kemister från University of Groningen har skapat ett nytt enzym med en onaturlig aminosyra som sitt aktiva centrum. De tillverkade enzymet genom att modifiera ett antibiotikumbindande protein som normalt fungerar som en bakteriell transkriptionsfaktor. Ytterligare modifieringar av det reaktiva stället kan skapa olika enzymer för användning i kemisk syntes. En beskrivning av det nya enzymet publicerades i Naturkemi den 2 juli.
Den kemiska industrin arbetar hårt för att ersätta konventionella processer, som kan använda giftiga kemikalier eller mycket energi, med miljövänligare alternativ. Ett populärt alternativ är enzymer, som vanligtvis fungerar i vatten vid måttliga temperaturer. Dock, antalet reaktioner som katalyseras av naturliga enzymer är begränsat jämfört med vad som finns tillgängligt inom kemi. "Det är därför enzymdesign verkligen har tagit fart de senaste åren, " säger universitetet i Groningen professor i biomolekylär kemi Gerard Roelfes.
Ökad katalys
Enzymer kan konstrueras på olika sätt. Än, än så länge, endast de 20 naturligt förekommande aminosyrorna har använts för att skapa enzymernas aktiva plats. Detta begränsar antalet reaktioner som dessa designade enzymer kan utföra, argumenterar Roelfes:"Vi tror att inkorporering av icke-standardiserade aminosyror i proteiner kan avsevärt utöka repertoaren av designerenzym."
Hans team använde en bakteriell transkriptionsfaktor som utgångspunkt för sin design. LmrR-proteinet är en transkriptionsregulator i bakterien Lactococcus lactis, som svarar på antibiotika; den katalyserar inte kemiska reaktioner av sig själv. Det är en munkformad dimer med en central öppning som binder hydrofoba molekyler. Med hjälp av utökad genetisk kodteknik, Roelfes och hans kollegor introducerade den onaturliga aminosyran p-aminofenylalanin till proteinet på ett sådant sätt att sidokedjans anilin fanns i den centrala öppningen. "Anilin är en känd katalysator i kemisk syntes, men inte särskilt potent. Att introducera det till LmrR-proteinet, ökade katalysen med nästan tre storleksordningar."

Proteinstruktur av LmrR poren. När en onaturlig aminosyra, p-aminofenylalanin, införs i denna por, den inneboende katalytiska aktiviteten hos anilin-sidokedjan (röd struktur) förstärks med nästan tre storleksordningar för en modell av hydrazonbildning. Kredit:Clemens Mayer / University of Groningen
Olika reaktiviteter
Det nya enzymet länkar organiska molekyler genom att bilda en hydrazonstruktur, en reaktion som används inom medicinsk bioteknik, till exempel, att koppla läkemedel till antikroppar. "I våra experiment, vi använde en reaktion som ger en vackert färgad produkt, så att vi enkelt kunde mäta aktiviteten hos det nya enzymet." Roelfes och hans team modifierar nu den centrala öppningen för att öka effektiviteten hos enzymet och skräddarsy det efter specifika reaktioner.
"Det finns många alternativ att använda denna enzymdesign i kemisk syntes, " säger Roelfes "Och vi skulle också kunna introducera andra onaturliga aminosyror som har olika reaktivitet." Genom att kombinera dessa nya katalytiska egenskaper med det promiskuösa bindningsstället för LmrR-proteinet, Roelfes är övertygad om att många nya användbara enzymer kan skapas.