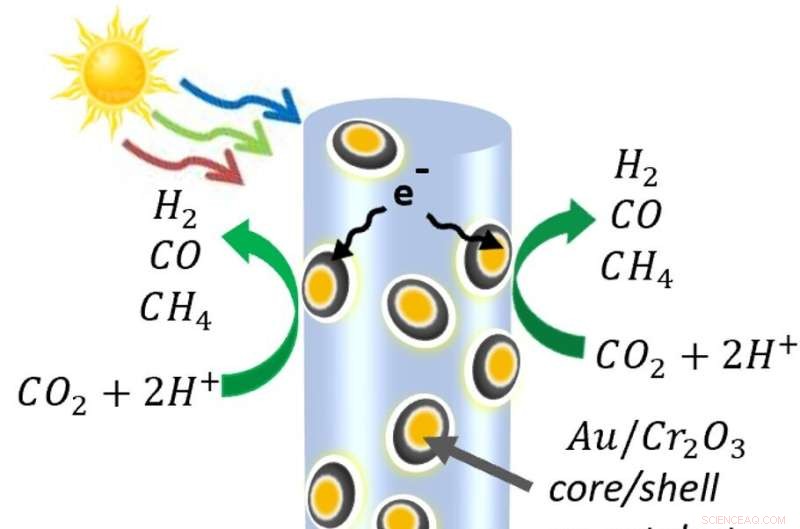
Ett diagram över halvledarnanotrådarna gjorda av indium, gallium och kväve – dekorerade med guld- och kromoxidnanopartiklar. När ljuset träffar nanotråden frigör det elektroner och de positivt laddade "hålen" som elektronerna lämnar efter sig. På själva nanotråden oxiderar hålen vatten till protoner (väte) och syre. Under tiden dras en del elektroner in i metallnanopartiklarna, där de bryter isär koldioxid. Molekylerna rekombineras till kolmonoxid-, väte- och metanmolekylerna som utgör syngas. Kredit:Roksana Rashid, McGill University.
Soldriven syntesgas kan återvinna koldioxid till bränslen och användbara kemikalier, har ett internationellt team av forskare visat.
"Om vi kan generera syngas från koldioxid med enbart solenergi kan vi använda detta som en prekursor för metanol och andra kemikalier och bränslen. Detta kommer att avsevärt minska den totala CO2 utsläpp", säger Zetian Mi, professor i el- och datorteknik vid University of Michigan, som ledde studien som publicerades i Proceedings of the National Academy of Science .
Syngas, som huvudsakligen består av väte och kolmonoxid med lite metan, kommer vanligtvis från fossila bränslen med hjälp av elektricitet. Dessutom tillsätts ofta giftiga kemikalier för att göra processen effektivare.
"Vår nya process är faktiskt ganska enkel, men det är spännande eftersom det inte är giftigt, det är hållbart och det är väldigt kostnadseffektivt", säger Roksana Rashid, första författare till studien, som utförde experimenten som doktorand i elektro- och datateknik vid McGill University i Kanada.
För att skapa en process som bara använder solenergi övervann Mi:s grupp svårigheten att splittra koldioxidmolekyler, som är bland de mest stabila i universum. För detta pepprade de en skog av halvledarnanotrådar med nanopartiklar. Dessa nanopartiklar, gjorda av guld belagd med kromoxid, drog till sig koldioxidmolekylerna och böjde dem, vilket försvagade bindningarna mellan kolet och syret.
Galliumnitridnanotrådarna använde ljusenergin för att frigöra elektroner och de positivt laddade utrymmen de lämnar efter sig, så kallade hål. Hålen delar vattenmolekyler, separerar protonerna (väte) från syret. Sedan, vid metallkatalysatorerna, delar elektronerna koldioxiden, producerar kolmonoxid och ibland drar in det fria vätet för att göra metan. Processer är under utveckling för att separera syret från de andra gaserna.
"Vår teknik kastar ljus över hur man bygger distribuerad syngasproduktion från luft, vatten och solljus", säger Baowen Zhou, motsvarande författare till studien tillsammans med Mi och en tidigare postdoktor i Mi:s labb vid McGill University och U-M.
Genom att ändra förhållandet mellan guld och kromoxid i nanopartiklarna kunde Mi:s team kontrollera de relativa mängderna väte och kolmonoxid som produceras i reaktionen. Detta är viktigt eftersom förhållandet mellan väte och kolmonoxid påverkar hur lätt det är att producera en typ av bränsle eller kemikalie.
"Det som är förvånande är synergin mellan guld och kromoxid för att göra CO2 reduktion till syngas effektiv och avstämbar. Det var inte möjligt med en enda metallkatalysator," sa Mi. "Detta öppnar upp för många spännande möjligheter som inte tidigare övervägdes."
Mi:s inställbara syngassetup använder standard industriella tillverkningsprocesser och är skalbar. Medan Rashid använde destillerat vatten i det här experimentet, förväntas havsvatten och andra elektrolytlösningar också fungera, och Mi har använt dem i relaterade vattenuppdelningsstudier.
"Halvledaren vi använder som ljusabsorbent är baserad på kisel och galliumnitrid, som är de vanligaste halvledarna, och vi använder väldigt lite material för galliumnitriden. Varje nanotråd är ungefär en mikrometer i tjocklek", sa Mi.
Mi:s nästa mål är att öka effektiviteten hos enheten, som för närvarande ligger på 0,89 %. När 10% av ljusenergin omvandlas till kemisk energi, hoppas han att tekniken skulle kunna få tekniken att användas för förnybar energi, liknande solceller. + Utforska vidare