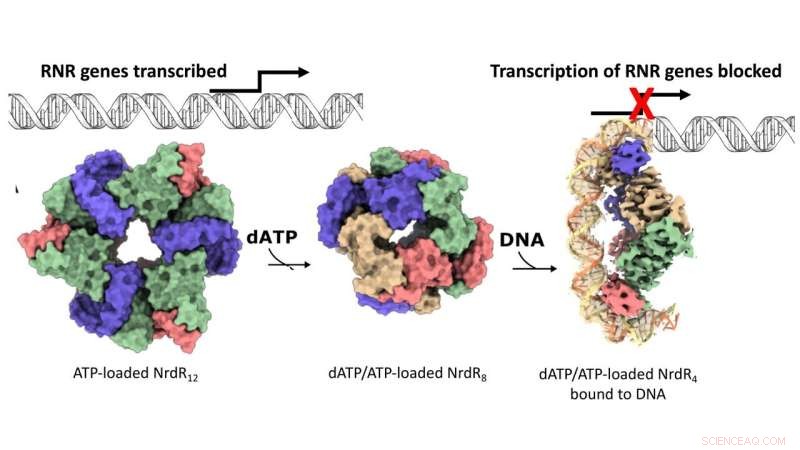
Verkningsmekanismen för den RNR-specifika repressorn NrdR. Ytrepresentation av cryo-EM-kartorna för de dodecameriska, oktameriska och DNA-bundna tetramera NrdR-strukturerna. NrdR-monomerer i varje tetramerenhet är färgade beige, blå, grön och rosa. DNA visas schematiskt, förutom den del som löses med cryo-EM där de två antiparallella DNA-strängarna är orange respektive ljusgul. Kredit:Inna Rozman Grinberg
I en ny studie publicerad i Nature Communications , visar forskare från Stockholms universitet för första gången hur NrdR binder till DNA för att hämma RNR. Den nya mekanismen kan hjälpa forskare att designa bättre antibiotika genom att rikta in sig på en patogens förmåga att fortplanta sig.
"Vi upptäckte NrdR för mer än ett decennium sedan men hur det fungerar var en gåta. I den här artikeln kombinerade vi biokemiska och strukturella studier för att ta reda på hur NrdR binder till DNA", säger Inna Rozman Grinberg, forskare vid institutionen för biokemi och Biofysik vid Stockholms universitet och huvudförfattare till studien.
DNA-syntes är processen att skapa nya DNA-molekyler som äger rum när en cell delar sig. I praktiskt taget alla levande organismer utgör enzymet ribonukleotidreduktas (RNR) byggstenar för de nya DNA-strängarna. Hos många bakterier, inklusive välkända patogener som Mycobacterium tuberculosis, stängs syntes av RNR av av repressorproteinet NrdR. Den mekanism som underbygger samspelet mellan RNR och NrdR förblev dock svårfångad. I allmänhet, när bakterieceller delar sig, aktiveras RNR för att tillhandahålla byggstenar för att göra nytt DNA. Under tiden förblir NrdR avstängd. Sedan, när DNA-syntesen är klar, binder NrdR till DNA och förhindrar ytterligare syntes av RNR.
Men hur känner celler av när det är dags att stänga av RNR? Svaret ligger i det relativa koncentrationsförhållandet mellan två nyckelmolekyler, nämligen adenosintrifosfat (ATP) och deoxiadenosintrifosfat (dATP). Forskarna visade att vissa RNR:er kan stänga av sig själva när höga dATP-nivåer är närvarande. NrdR, å andra sidan, binder bara till DNA och hämmar syntesen av RNR när dATP-nivåerna är höga. Denna avkänningsmekanism, som nästan uteslutande används av RNR och NrdR, förmedlas via en proteindomän som kallas "ATP-kon."
"Denna mekanism belyser en spännande aspekt av proteinutvecklingen", säger Inna Rozman Grinberg.
Enligt Inna Rozman Grinberg kan ATP-konen användas som ett antibiotikamål mot patogener med en enda RNR, eller mot patogener med NrdR för att kontrollera alla deras RNR eftersom NrdR finns i bakterier men saknas hos människor. "Vad vi vet är detta det enda exemplet på en evolutionär mobil proteindomän som styr både uttrycket och aktiviteten av ett enzym." + Utforska vidare