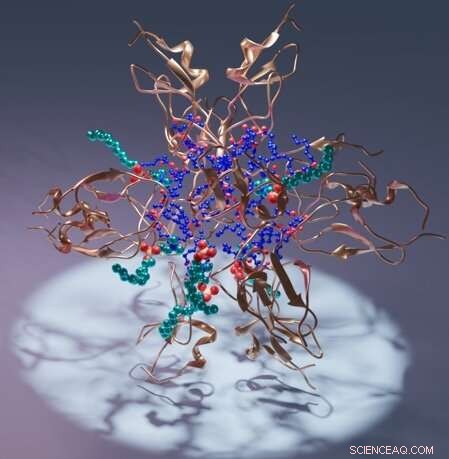
Konstnärlig återgivning av en proteinkinas C C1-domän (koppar), dess ligand diacylglycerol (blå) och detergent (cyan). Kredit:Sachin Katti.
I ett stort framsteg för rationell läkemedelsdesign har ett Texas A&M AgriLife-team beskrivit flera proteinstrukturer för en avgörande aktör i cellulära processer. Framsteg kan ge nya idéer för behandlingar av sjukdomar som Alzheimers, AIDS, cancer och andra.
Specifikt beskriver arbetet C1-domänen av proteinkinas C, PKC, som hjälper till att reglera proteinets aktivitet i organismer. I strukturerna sveper C1-domänen runt olika molekyler av intensivt terapeutiskt intresse, vilket ger den första pålitliga guiden med atomupplösning för att utforma läkemedelskandidater.
Publicerad 16 maj i Nature Communications , leddes forskningen av Tatyana Igumenova, Ph.D., docent vid institutionen för biokemi och biofysik vid Texas A&M College of Agriculture and Life Sciences. Projektets främsta författare är Sachin Katti, Ph.D., en postdoktor som arbetar med Igumenova.
Studien involverade ett samarbete med Inna Krieger, Ph.D., forskningsbiträdande professor, och James Sacchettini, Ph.D., professor, båda vid institutionen för biokemi och biofysik.
En av de mest eftertraktade proteinstrukturerna
En frisk cell reagerar på kemiska signaler på exakta, intrikata sätt. Att ta emot kemiska input från cellens miljö och vidarebefordra dem till de centrala kontrollsystemen inom cellkärnan är uppgiften för specialiserade proteiner som PKC.
Felaktig PKC-aktivitet visar sig i många mänskliga sjukdomar. Som ett resultat finns det ett stort intresse för att hitta sätt att finjustera PKC-aktivitet med droger. Utformningen av sådana läkemedel kommer att erbjuda nya metoder för behandling av Alzheimers sjukdom, AIDS, cancer och mer.
"Proteinkinas C är ett av de mest intensivt studerade proteinerna inom cellbiologi och farmakologi," sa Igumenova. "Ett stort hinder har varit bristen på exakt strukturell information för att vägleda insatser för läkemedelsdesign."
En komplikation för läkemedelsdesign är att PKC-familjen har 11 medlemmar. Olika PKC-familjemedlemmar kan ha motsatta fysiologiska effekter, så en framgångsrik läkemedelskandidat måste vara selektiv med vilken PKC den riktar sig till.
För att göra det måste läkemedelskandidater passa en mål-PKC som en nyckel till ett lås. Men att bestämma 3D-strukturen för en PKC "on-switch" – C1-domänen – bunden till PKC-aktivatorer har inte varit lätt.
Proteinstrukturer löses vanligtvis med röntgenkristallografi. Tekniken innebär att man använder röntgenstrålar för att bestämma atomernas position i en kristall. För denna metod måste forskare skapa förutsättningar där proteinet av intresse kristalliseras. Men intensiva ansträngningar i många forskningslaboratorier under de senaste tre decennierna misslyckades med att ge kristaller av C1-domäner bundna till relevanta ligander. På grund av denna brist på framsteg, uttalade flera forskare uppgiften omöjlig, sa Igumenova.

Kristaller av en domän av proteinkinas C bildades spontant i Kattis NMR-provrör. Kredit:Sachin Katti.
Lösa ett 30-årigt problem
Katti och Igumenova accepterade problemet som utmanande och bestämde sig istället för att studera molekylerna i lösning med hjälp av kärnmagnetisk resonans, NMR, spektroskopi. Detta innebar att hitta rätt komponenter för att efterlikna cellmembran, där C1-domänen skulle stöta på ligander.
"Så, en vacker dag, upptäckte Sachin att kristaller bildades i ett gammalt NMR-rör," sa Igumenova. "Jag ger all ära till Sachin, som i princip sa:" Jag ska gå och testa dem och se om de faktiskt är proteinet. Och han hade rätt. Det gav oss förtroende för att kristallisering är möjlig."
I sin tur ger Katti trovärdighet åt insikterna från NMR, och lite tur.
"Jag tror att det är det fina med att göra forskning där du måste använda flera tillvägagångssätt," sa han. "Du vet aldrig när ett tillvägagångssätt kommer att vara användbart för att göra något med andra tillvägagångssätt."
Insikter från NMR och röntgenkristallografi
De nya proteinstrukturerna, tillsammans med teamets NMR-resultat, har redan gett intressant information. Ett långvarigt mysterium har varit hur C1-domäner kan rymma ligander som har väldigt olika kemiska strukturer, sa Igumenova.
"Vårt tidigare NMR-arbete indikerade att slingorna i C1-domänen som binder ligander är mycket dynamiska," sa Igumenova. "Den här C1-domänen är som en PAC-man. Den binder membranet och söker sedan efter en ligand. När den väl hittar liganden låser den sig."
Dessutom visar strukturen att det ligandbindande spåret har en "vattenälskande" eller hydrofil yta längst ner och "vattenavvisande" eller hydrofob yta upptill.
"Om du tänker på en lipidmolekyl är huvudgruppen hydrofil och svansen hydrofob," sa Igumenova. "Så, när C1-domäner binder lipidligander matchar mönstren."
Teamets resultat inkluderar strukturen av en C1-domän bunden till dess naturliga ligand, diacylglycerol. Dessutom beskriver teamet flera andra strukturer av C1 som inkluderar olika föreningar av farmakologiskt intresse.
Arbetet ger också en metod för att testa olika läkemedelskandidater, sa Katti.
"Om du vill studera fiskar, vill du studera dem i vatten," sa Katti. "Nu vet vi hur man skapar en membranliknande miljö där dessa mycket hydrofoba föreningar kan testas för C1-bindning."
Därefter planerar Katti och Igumenova att utforska C1-domäner från andra PKC-familjemedlemmar.
"Det är viktigt för oss att fokusera på C1-domäner eftersom de har inneboende skillnader som kan utnyttjas för att uppnå selektivitet," sa Igumenova. "Vad vi finner nu är att inte alla C1-domäner är skapade lika." + Utforska vidare