Grafiskt abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.1c12407
Forskare från University of East Anglia har identifierat en ny klass av enzymer som är involverade i stresshantering hos bakterier.
Alla organismer, från människor till bakterier, måste kunna reagera på ett brett spektrum av påfrestningar som är ett resultat av förändringar i deras miljö.
Vanliga bland dessa är så kallade oxidativa och nitrosativa påfrestningar, som uppstår när en organism utsätts för höga koncentrationer av reaktionssyre respektive reaktiva kvävearter. När detta händer skadas bräckliga komponenter i cellen, vilket leder till funktionsförlust och i vissa fall celldöd.
Föga överraskande har organismer utvecklat en mängd stressresponssystem som upptäcker och lindrar speciella påfrestningar.
Järn-svavelkluster, som består av järn och oorganiskt svavel, finns i alla celltyper där de spelar väsentliga roller i en lång rad cellulära processer. Eftersom de är så reaktiva är de ofta de första cellulära komponenterna som skadas under stressförhållanden.
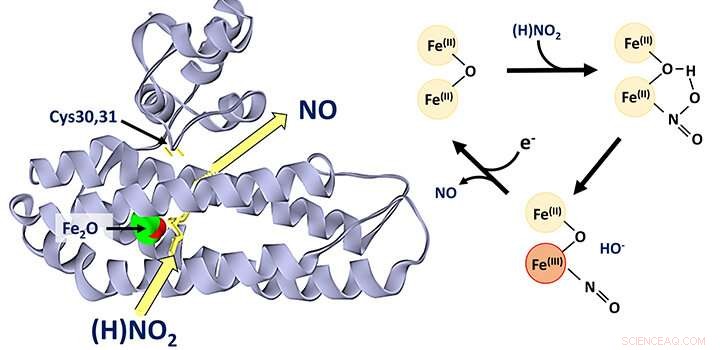
Di-järnproteinet YtfE, som finns allmänt i bakterier, anses allmänt fungera direkt vid reparation av järn-svavelkluster som har skadats under stressförhållanden. Denna aktivitet har varierande föreslagits för att involvera donation av järn för återuppbyggnad av järn-svavelkluster, eller avlägsnande av kväveoxid (NO) från skadade kluster.
Nyligen framkom nya bevis från studier av YtfE-funktion i celler som tydde på att dess aktivitet är associerad med en ökning, och inte en minskning, i koncentrationen av NO. Detta fick forskare vid Kemihögskolan att ompröva funktionen hos YtfE.
Teamet, som leds av Dr Jason Crack och Prof Nick Le Brun, och som involverar Dr Fraser MacMillans labb, samt forskare från University of Birmingham och University of Sheffield, har upptäckt att YtfE är en ny typ av nitritreduktasenzym som producerar NO.
De visade att YtfE inte effektivt tar bort NO från skadade järn-svavelkluster, och det är inte heller en effektiv givare av järn för klustersammansättning.
Den YtfE-katalyserade produktionen av giftig NO från nitrit (NO2 - ) kan verka konstigt, men YtfE samregleras med ett annat enzym, kallat Hcp, som fungerar för att avgifta NO (via dess reduktion till dikväveoxid, N2 O).
Den kopplade YtfE/Hcp-avgiftningsvägen representerar ett effektivt sätt genom vilket cellen hanterar toxiska nivåer av nitrit som kan uppstå under anaeroba förhållanden.
Teamet använde en rad olika tillvägagångssätt, inklusive in vivo genetisk och in vitro proteinspektroskopi och masspektrometri, för att få detaljerad inblick i mekanismen genom vilken YtfE genererar NO från nitrit.
Arbetet klargör rollen av ett protein som har förbryllat forskare under lång tid, och visar att YtfE är en nyckelspelare för att hantera stress under förhållanden med anaerob andning, som de som finns i människans tarm eller när man infekterar en mänsklig värd.
Verket publiceras denna vecka i Journal of the American Chemical Society . + Utforska vidare