I kampen mot cancer och andra sjukdomar utvecklar forskare molekylära vapen som kan användas för att stoppa okontrollerbar celltillväxt.
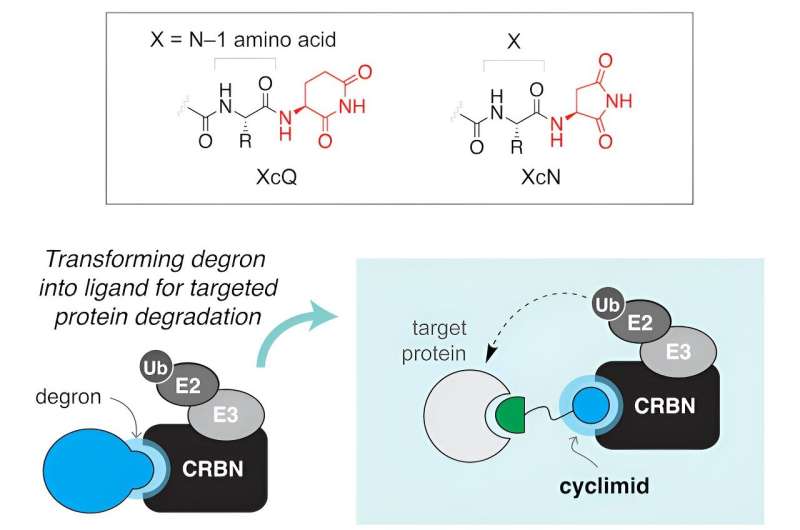
Ett team av forskare från Harvard och Massachusetts General Hospital har funnit att "cyklimider", en klass av bindande molekyler som kallas ligander, erbjuder ett lovande och effektivt tillvägagångssätt för att ta bort proteiner som orsakar sjukdomar eller som inte fungerar. Deras distinkta egenskaper gör det möjligt för forskare att attackera felande proteiner vid sina molekylära rötter.
"I över ett år hade vi tagit itu med frågan om vilka naturliga ligander som känns igen av cereblon, ett protein som är avgörande för riktad nedbrytning", säger senior medförfattare Christina Woo, Morris Kahn docent i kemi och kemisk biologi. "Denna studie karakteriserar dessa ligander heltäckande för att ge nya insikter om cereblons biologi och hur man kapar den."
Under de senaste åren har forskare konstruerat små molekyler för att specifikt rikta in sig på proteiner associerade med sjukdom. Dessa molekyler har två roller:de låser sig på målproteinet som måste avlägsnas, och deras "stridsspets" samverkar med en del av det cellulära rensningssystemet, ofta bindande till ett protein som kallas cereblon. Tillsammans bildar dessa specialiserade molekyler vad forskare kallar ett ternärt komplex. När detta komplex är etablerat, markeras målproteinet effektivt för bortskaffande av cellens proteasom, som fungerar som ett cellulärt återvinningssystem.
Framgången för denna process – att ta bort specifika proteiner – är beroende av utformningen och effektiviteten hos den molekylära stridsspetsen, vilket gör dem till avgörande element i utvecklingen av terapier för olika sjukdomar, inklusive cancer.

I forskarnas artikel publicerad i Cell Chemical Biology , fann de att mindre strukturella förändringar på cereblonliganden dramatiskt kan förändra biologiska aktiviteter i celler. I samarbete med Mazitschek Lab, som har gjort omfattande forskning om identifiering av sjukdomsrelevanta molekylära mål, introducerade forskarna ett systematiskt biokemiskt tillvägagångssätt för att kvantifiera bildning av ternärt komplex. Denna metod gör det möjligt för forskare att förutsäga den cellulära nedbrytningsaktiviteten hos cyklimider mer effektivt, vilket effektiviserar utvecklingsprocessen.
"Vi har gett samhället ett kraftfullt och prisvärt mikroskop med vår metod," sa Ralph Mazitschek, co-senior författare. "Vi har etablerat en omfattande, pålitlig, robust och känslig profileringsplattform som är tillämpbar på praktiskt taget alla dessa små molekylnedbrytare och molekylära limnedbrytare."
"Detta var ett samarbete i ordets rätta bemärkelse", säger Connor Payne, postdoktor vid Mazitscheks labb. "Vi hade olika expertis och olika teknologier som vi utvecklade så synergin mellan dem var riktigt, riktigt vacker att se komma till stånd."
Framöver är Woo och Mazitschek optimistiska om att cyklimider och deras screeningplattformar kommer att införlivas i proteinnedbrytningsstrategier, vilket kan vara användbart för att utveckla läkemedel och behandla cancer.
"Jag tror att vår forskning i slutändan kommer att underlätta profilering av många fler molekyler mot önskade mål och komma fram till mer selektiva och effektiva molekyler snabbare," sa Woo. "Det finns många olika riktningar detta kan ta oss."
Mer information: Saki Ichikawa et al, The cyclimids:Degron-inspired cereblon binders for targeted protein degradation, Cell Chemical Biology (2024). DOI:10.1016/j.chembiol.2024.01.003
Journalinformation: Cellkemisk biologi
Tillhandahålls av Harvard University
Denna berättelse publiceras med tillstånd av Harvard Gazette, Harvard Universitys officiella tidning. För ytterligare universitetsnyheter, besök Harvard.edu.