Antibiotikaresistenta "superbuggar" som kan besegra försök att döda dem är en akut folkhälsokris, och enligt Centers for Disease Control inträffar mer än 2,8 miljoner antibiotikaresistenta infektioner varje år. Forskare över hela världen kämpar för att möta utmaningen.
Ett samarbetsteam av forskare ledda av University of Massachusetts Amherst och inklusive forskare från bioläkemedelsföretaget Microbiotix tillkännagav nyligen att de framgångsrikt hade lärt sig hur man saboterar en nyckelbit som patogener använder för att infektera sina värdceller, och har utvecklat ett test för att identifiera nästa generations läkemedel för att rikta in sig på detta sårbara cellulära maskineri och göra verkliga vinster i folkhälsan.
Den typiska strategin vid behandling av mikrobiella infektioner är att spränga patogenen med ett antibiotiskt läkemedel, som fungerar genom att ta sig in i den skadliga cellen och döda den. Detta är inte så lätt som det låter, eftersom varje nytt antibiotikum måste vara både vattenlösligt, så att det lätt kan färdas genom blodomloppet, och oljigt, för att passera den patogena cellens första försvarslinje, cellmembranet. Vatten och olja blandas naturligtvis inte, och det är svårt att designa ett läkemedel som har tillräckligt med båda egenskaperna för att vara effektivt.
Svårigheten slutar inte heller där, eftersom patogena celler har utvecklat något som kallas en "utflödespump", som kan känna igen antibiotika och sedan säkert utsöndra dem från cellen, där de inte kan göra någon skada. Om antibiotikan inte kan övervinna effluxpumpen och döda cellen, då "minns" patogenen hur det specifika antibiotikumet ser ut och utvecklar ytterligare effluxpumpar för att effektivt hantera det – i själva verket blir resistenta mot just det antibiotikumet.
En väg framåt är att hitta ett nytt antibiotikum, eller kombinationer av dem, och försöka ligga steget före superbuggarna.
"Eller så kan vi ändra vår strategi", säger Alejandro Heuck, docent i biokemi och molekylärbiologi vid UMass Amherst och tidningens senior författare. "Jag är en kemist och jag har alltid varit väldigt intresserad av att förstå hur kemiska molekyler interagerar med levande organismer. Jag har särskilt fokuserat min forskning på de molekyler som möjliggör kommunikation mellan en patogen och värdcellen den vill invadera."
Heuck och hans kollegor har varit särskilt intresserade av ett kommunikationssystem som kallas typ 3-sekretionssystemet, som hittills verkar vara en evolutionär anpassning unik för patogena mikrober.
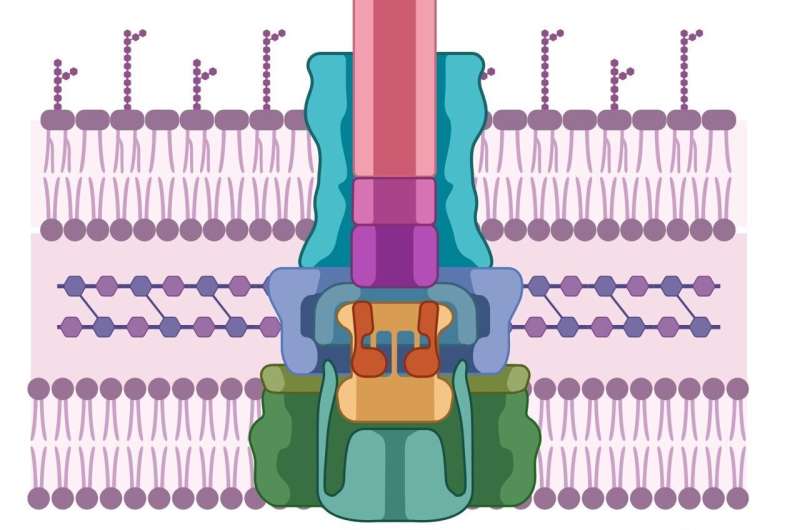
Liksom den patogena cellen har även värdceller tjocka, svårgenomträngliga cellväggar. För att bryta mot dem har patogener utvecklat en sprutliknande maskin som först utsöndrar två proteiner, kända som PopD och PopB. Varken PopD eller PopB kan individuellt bryta cellväggen, men de två proteinerna tillsammans kan skapa ett "translokon" - den cellulära motsvarigheten till en tunnel genom cellmembranet. När tunneln väl är etablerad kan den patogena cellen injicera andra proteiner som gör arbetet med att infektera värden.
Hela denna process kallas typ 3-sekretionssystemet - och inget av det fungerar utan både PopB och PopD. "Om vi inte försöker döda patogenen", säger Heuck, "då finns det ingen chans för den att utveckla resistens. Vi saboterar bara dess maskin. Patogenen lever fortfarande; den är bara ineffektiv och värden har tid att använda sitt naturliga försvar för att bli av med patogenen."
Frågan är då hur man hittar molekylen som kan blockera sammansättningen av translokonet?
Ibland kommer lösningar till forskare i de där "glödlampsögonblicken" när allt plötsligt är vettigt. I det här fallet var det mer ett blixtljud.
Heuck och hans kollegor insåg att en enzymklass som kallas luciferaser - liknande de som får blixtar att lysa på natten - kunde användas som spårämne. De delar enzymet i två halvor. Ena hälften gick in i PopD/PopB-proteinerna, och den andra hälften konstruerades till en värdcell.
Dessa konstruerade proteiner och värdar kan översvämmas med olika kemiska föreningar. Om värdcellen plötsligt tänds, betyder det att PopD/PopB framgångsrikt bröt cellväggen, återförenade de två halvorna av luciferaset, vilket fick dem att glöda. Men om cellerna förblir mörka? "Då vet vi vilka molekyler som bryter translokonet", säger Heuck.
Heuck är snabb med att påpeka att hans teams forskning inte bara har uppenbara tillämpningar inom läkemedelsvärlden och folkhälsa, utan att den också främjar vår förståelse av exakt hur mikrober infekterar friska celler. "Vi ville studera hur patogener fungerade", säger han, "och så upptäckte vi plötsligt att våra fynd kan hjälpa till att lösa ett folkhälsoproblem."
Denna forskning är publicerad i tidskriften ACS Infectious Diseases .
Mer information: Hanling Guo et al, cellbaserad analys för att bestämma typ 3-sekretionssystemets translokonsammansättning i Pseudomonas aeruginosa med användning av splitt luciferas, ACS-infektionssjukdomar (2023). DOI:10.1021/acsinfecdis.3c00482
Journalinformation: ACS-infektionssjukdomar
Tillhandahålls av University of Massachusetts Amherst