Byggstenarna för nya läkemedel som hjälper till att bekämpa bakterier som är resistenta mot till exempel kända antibiotika ska vara så kostnadseffektiva och miljövänliga som möjligt. Enzymer är idealiska för detta ändamål. De kan till exempel producera eller kombinera olika komponenter av aktiva substanser.
Simon Schröder karakteriserade i sin masteruppsats i Microbial Biotechnology-gruppen vid Ruhr-universitetet i Bochum ett enzym mer i detalj som har förmåga att bilda en önskad kväve-kvävebindning i molekyler. Han hittade också andra enzymer som kan göra detta. Verket publiceras i tidskriften Molecular Catalysis .
Forskare är i ständig konkurrens med skadliga mikroorganismer som utvecklar antibiotikaresistens. I jakten på nya aktiva substanser försöker de traditionellt isolera mikroorganismer från naturen som uppvisar antibiotikabeteende. De identifierar sedan de ansvariga ämnena och studerar deras funktion. Idag kompletteras denna process av datorstödda metoder som gör det möjligt att designa skräddarsydda nya molekyler som har specifika effekter på organismer och deras metaboliska processer.
"Men designen och produktionen av sådana konstgjorda föreningar begränsas ofta av vilka prekursormolekyler eller byggstenar som finns tillgängliga för deras produktion", förklarar Schröder. Helst bör deras produktionsprocess vara ekonomisk och ekologisk, till exempel genom att använda mikroorganismer eller deras katalytiska enzymer. Utbyggnaden av det modulära systemet av tillgängliga molekyler för att producera nya läkemedel är därför lika viktig och intressant.

Göra den önskade bindningen mer lättillgänglig
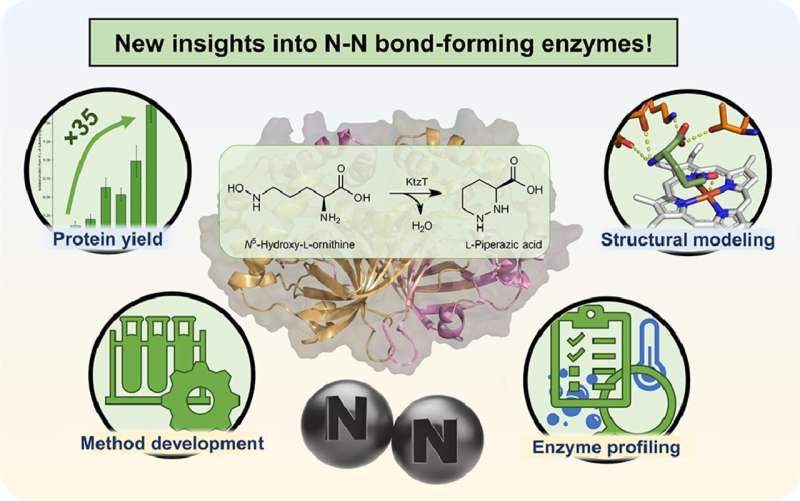
"Vi arbetar med produktionen av en specifik typ av sådana molekyler", förklarar Schröder. 2017 isolerades ett enzym som kan bilda kväve-kvävebindningen i molekyler, vilket sällan finns i naturen. Det är dock fortfarande väldigt lite känt om detta enzym med det systematiska namnet "KtzT":Hur fungerar det? I vilka föreningar kan den bilda denna bindning? Är det lämpligt att producera farmaceutiskt relevanta molekyler?
"Inledningsvis kunde vi förbättra produktionen och isoleringen av detta enzym i laboratoriet med en faktor 35", rapporterar Schröder. "Detta gjorde det möjligt för oss att karakterisera KtzT, det vill säga att identifiera dess optimala reaktionsförhållanden:Vid vilken temperatur, vilket pH-värde fungerar det bäst och hur stabilt är det under ett brett spektrum av förhållanden?"
Forskargruppen har också hittat och isolerat KtzT-liknande enzymer och visat att de också kan katalysera reaktionen. "Vi kunde också implementera en flerstegsreaktion med flera enzymer, vilket gjorde kväve-kvävebindningen ännu lättare att komma åt", säger Schröder.
Han använde bland annat bioinformatiska metoder för att utveckla en strukturell modell av enzymet, som gör det möjligt att göra hypoteser angående reaktionsmekanismen och att enzymet specifikt modifieras så att det även kan bilda kväve-kvävebindningen i andra föreningar.
Mer information: Simon Schröder et al, Förbättring av biokatalytisk N–N-bindningsbildning med det aktinobakteriella piperazatsyntaset KtzT, Molecular Catalysis (2023). DOI:10.1016/j.mcat.2023.113733
Tillhandahålls av Ruhr-Universitaet-Bochum