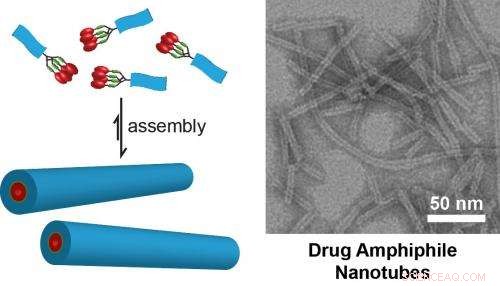
(Vänster) Schematisk illustration av designkonceptet för självmonterande drogamfifiler. Läkemedelsbelastningen inom de självmonterade nanostrukturerna definieras av naturen hos molekylär design. (Till höger) TEM-bild av nanorör som bildas genom självmontering av en drogamfifil innehållande fyra kamptotecinläkemedel. Dessa nanorör har en fast läkemedelsbelastning på 38 % (vikt/vikt). Bild från Cui Lab vid Johns Hopkins University. Kredit:Cui Lab, Institutionen för kemi och biomolekylär teknik, Johns Hopkins University
(Phys.org) – De senaste åren, många populära cancerbehandlingar har använt nano, det är, små partiklar av polymerer eller kolbaserade material för att transportera kemoterapiläkemedel till tumörer på ett sätt som specifikt riktar sig mot cancerceller, samtidigt som man skonar normala celler. Men detta tillvägagångssätt har flera problem.
Bland annat, det är svårt att kontrollera mängden drog som laddas i bäraren, och, faktiskt, alltför ofta finns det mycket mer "bärar"-material än drog. Som ett resultat, läkemedelsmängden varierar ofta från partikel till partikel, vilket betyder att den kemoterapidos som ges kan vara inkonsekvent eller ojämn. Också, det syntetiska materialet som omsluter och levererar läkemedlet kan i sig vara giftigt, orsakar oönskade biverkningar.
Det idealiska scenariot skulle vara att hitta ett sätt att förvandla cancerläkemedel till sina egna leveranssystem, och eliminera de syntetiska fordonen helt och hållet.
Honggang Cui, biträdande professor i kemi- och biomolekylär teknik vid Johns Hopkins University försöker göra just det genom att omvandla läkemedelsmolekylerna på ett sätt som gör det möjligt för dem att bli sina egna bärare, en process som kallas självmontering.
"Vi vill använda anti-cancerläkemedlet för att göra nanopartiklar av sig själv, säger Cui, också en ansluten fakultetsmedlem till Johns Hopkins Institute for NanoBioTechnology. "Utmaningen är:Hur gör vi det?"
National Science Foundation (NSF)-finansierade forskare och hans forskargrupp använder nya molekylära ingenjörstekniker som de hoppas ska få läkemedelsmolekylerna att organisera sig i diskreta och isolerade nanostrukturer, snarare än att förbli i sin nuvarande "bulk" form.
Om han lyckas, arbetet skulle potentiellt kunna förbättra cancerkemoterapi genom att öka behandlingens effektivitet, och minska dess negativa biverkningar.
För närvarande, "i en partikel kan du ha 2 procent drogladdning, och i en annan, kanske 10 procent, och i en annan, ingenting, ingen drog alls, " säger han. Att låta drogerna transportera sig själva "kommer att hjälpa det kliniska resultatet, Cui tillägger. "Du kommer inte att få för mycket eller för lite av en drog. Du kommer att få rätt dos."
För att förvandla dessa läkemedel till sina egna leveranssystem i nanoskala, de måste bli amfifila, vilket innebär att de måste ha egenskaper som både gillar och ogillar vatten.
"Det vatten-ogilla-segmentet kommer att driva molekylerna att samlas för att bilda ett molekylärt kluster, eller en nanostruktur, på ett sätt att minimera deras kontakt med vattenmolekyler, medan det vattenliknande segmentet kommer att hålla nanostrukturen löslig i vattenlösning och hindra dem från att växa till större föremål, Cui förklarar.
Få droger har denna dualitet när det kommer till vatten. "De flesta är mycket hydrofoba, de har dålig vattenlöslighet, " han säger.
Att göra vattenhatande droger som också kan älska vatten, forskarna experimenterar med vattenlösliga peptider, som är föreningar som består av två eller flera aminosyror, försöker införliva dem i läkemedlen via biologiskt nedbrytbara länkar, det är, kemiska bindningar som fungerar som en brygga mellan den vattenälskande peptiden och den vattenhatande drogen.
När det fungerar, "läkemedlet kan bli självmonterande, " säger han. "När drogen får förmågan att självmontera, vi vill leka med peptidsekvensen för att få kontroll över dess storlek, form och ytkemi.
"Peptiden kommer inte bara att lägga till det vattenälskande segmentet för självmontering, men också nya funktioner som möjliggör effektiv reglering av deras montering i olika storlekar och former, " tillägger han. "De kan vara bioaktiva, och presentera signaler för specifik tumörinriktning."
Förhoppningen är att producera läkemedel mot cancer som är supramolekylära nanostrukturer, eller partiklar som består av mer än en molekyl, som "har hög drogladdning och fast drogladdning, " säger Cui.
"Belastningen inom nanostrukturen definieras av den molekylära designen, " tillägger han "Om läkemedelsfraktionen i den designade molekylen är 10 procent, nanostrukturen kommer också att ha 10 procent läkemedelsbelastning. Därför, genom molekylär design, man kan justera drogladdningen i nanostrukturen."
Cui bedriver sin forskning under ett NSF Faculty Early Career Development (CAREER)-pris som börjar i år. Priset stöder juniorfakulteten som exemplifierar rollen som lärare och forskare genom enastående forskning, utmärkt utbildning och integration av utbildning och forskning inom ramen för deras organisations uppdrag. NSF finansierar hans arbete med cirka $500, 000 under fem år.
Cui och hans team publicerade nyligen resultaten av sitt arbete i Journal of the American Chemical Society demonstrera principen för att konstruera självlevererande supramolekylära anticancerläkemedel. Deras arbete producerade nanofibrer och nanorör som bildades genom självmontering av peptid-anticancerkonjugat.
Som en del av anslagets utbildningsuppsökande, Cui planerar att bjuda in lokala gymnasie- och mellanstadieelever att spendera tid i hans labb.
"Drogleverans är till sin natur ett tvärvetenskapligt område som erbjuder enorma möjligheter till utbildning på alla nivåer, " säger han. "Vi vill särskilt engagera kommunala skolstudenter i innerstaden för att lära sig om system för drogtillförsel, och de bästa sätten att förbättra cancerbehandlingen."
Även om hans idéer fortfarande är långt från klinisk användning, Cui tror att det i slutändan kommer att vara möjligt att förvandla läkemedel till molekylära byggstenar som kommer att fungera som deras egna leveranssystem.
"Jag ser inga skäl till varför dessa självlevererande läkemedel inte kan översättas till kliniska miljöer när vi väl har kommit på sätt att manipulera deras självmonterande beteende, " han säger.