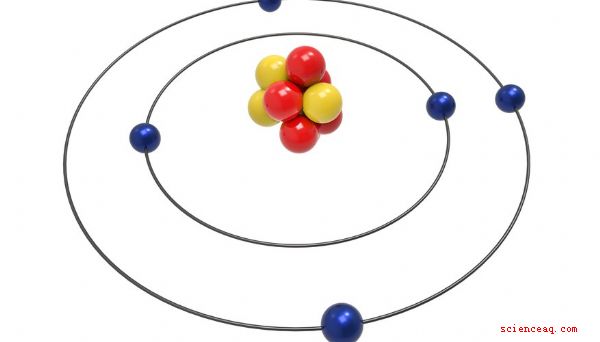
Atomer utgör allt. Allt med massa och volym, stora eller små, innehåller atomer. Otroligt nog innehåller de små atomerna ännu mindre partiklar. Protoner, neutroner och elektroner är de tre huvudkomponenterna i alla atomer. Antalet och arrangemanget av dessa tre otänkbara små partiklar avgör egenskaperna och beteendet hos atomerna som innehåller dem.
TL; DR (för lång; läste inte)
Att hitta numret av neutroner i en isotop, subtrahera antalet protoner från isotopens atommassa. Elementets atomantal är lika med antalet protoner. Beräkning av antalet neutroner blir sedan isotopens atommassa minus elementets atomantal lika med antalet neutroner. För uran-235, atomnummer 92, är antalet neutroner 235-92 \u003d 143, eller 143 neutroner.
Partiklar i atomer
Nästan alla atomer innehåller tre huvudpartiklar: protoner, neutroner och elektroner. Protoner och neutroner utgör atomens kärna eller centrum. Elektroner, mycket mindre än protoner och neutroner, cirklar runt kärnan och glider runt med ljusets hastighet. Protoner har en positiv laddning, neutroner har ingen laddning och elektroner har en negativ laddning. I en neutral atom är antalet protoner lika med antalet elektroner, men antalet neutroner är inte alltid lika med antalet protoner.
Identifiering av atomer
Antalet protoner i en atom avgör vilket typ av element som atomen bildar. Väte, det första elementet i det periodiska systemet, har bara en proton. Helium, tvåa på det periodiska bordet, har två protoner. Guld, nummer 79 på det periodiska bordet, har 79 protoner. Den periodiska tabellen över element visar elementen i ordning på antalet protoner i atomerna.
Isotoper av atomer.
En isotop av ett element betyder atomer med samma atomantal men olika massantal. Så, isotoper av ett element har ett annat antal neutroner. Väte har tre isotoper. Väte, den vanligaste formen av atomen, har en proton och en elektron. Deuterium, en isotop av väte, har fortfarande bara en proton och en elektron, men har också en neutron. Tritium, en annan väteisotop, har fortfarande bara en proton och en elektron men har två neutroner.
Beräkning av neutroner <<> En atoms massa består av de kombinerade massorna av protonerna och neutronerna. Elektronernas massa är försumbar i atomens totala massa. Protoner mäter ungefär en atommassaenhet och neutroner mäter bara lite mer än en atommasseenhet. För att hitta antalet neutroner i atomen, subtrahera atomnumret från atommassan.
Atomantalet och den genomsnittliga atommassan finns i det periodiska systemet. Massan av olika isotoper skrivs dock ofta som en del av namnet på isotopen. Uran-235 betyder elementet uran, atomnummer 92, har 92 protoner och en atommassa på 235. Å andra sidan har uran-238 en massa på 238 men har fortfarande endast 92 protoner. En alternativ metod för att skriva en isotop visar atommassan som ett superskript och atomnumret som ett subscript. Uran-235 kan också skrivas som 235 92 U där U är standardförkortningen för uran. Med användning av väteisotoper som exempel har den "normala" väteatomen en atommassa av 1, och atomnumret är 1, vilket betyder att atomen bara har en proton. Med hjälp av formeln ger atommassan 1 minus atomantalet eller antalet protoner av 1 ekvationen 1-1 \u003d 0, så väteatomen har 0 neutroner. Å andra sidan har tritium, en isotop av väte, en atommassa på 3 men atomantalet väte förblir 1 eftersom atomen bara har en proton. Med ekvationen är atommassa minus atomantal lika med antalet neutroner, ger 3-1 \u003d 2, så tritium har 2 neutroner. Ett annat vanligt element, kol, har också flera isotoper. Den normala kolatomen, atomnummer 6, har en atommassa på 12. Med formeln är atommassa minus atomantal lika med antalet neutroner, visar 12-6 \u003d 6, så kol-12-atomen har 6 neutroner. Kol-14, som används för radioaktiv ålderdatering av fossiler under 10 000 år, har fortfarande 6 protoner men har en atommassa på 14. Beräkning av antalet neutroner använder samma formel, så 14-6 \u003d 8, så kol-14 har 8 neutroner i dess kärna.