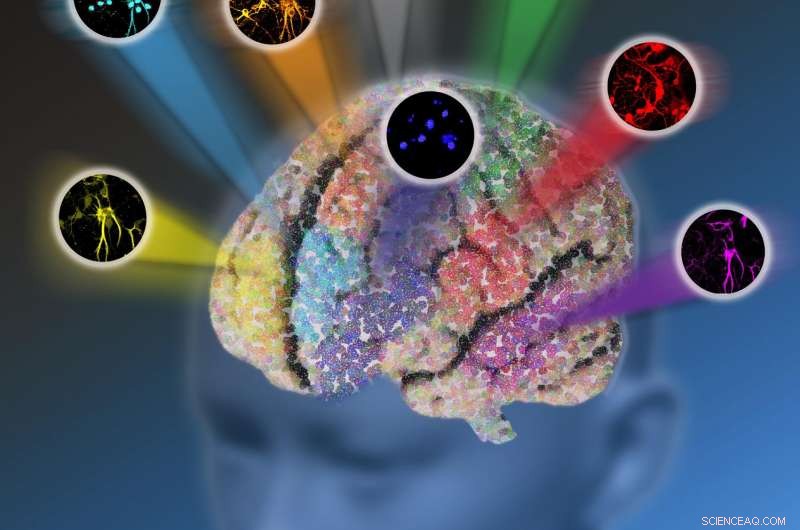
Forskare vid Columbia University utvecklade en ny optisk mikroskopi-plattform som kallas elektronisk pre-resonansstimulerad Raman-spridning (epr-SRS) mikroskopi som kombinerar en hög känslighet och selektivitet. Den innovativa tekniken möjliggör avbildning av upp till 24 biomolekylära strukturer åt gången istället för att begränsas av endast fem fluorescerande proteiner. Upphovsman:Nicoletta Barolini, Columbia University
Forskare vid Columbia University har tagit ett betydande steg mot att bryta den så kallade "färgbarriären" för ljusmikroskopi för biologiska system, möjliggör mycket mer omfattande, systemomfattande märkning och avbildning av ett större antal biomolekyler i levande celler och vävnader än vad som för närvarande är möjligt. Framstegen har potential för många framtida applikationer, inklusive att hjälpa till att styra utvecklingen av terapier för att behandla och bota sjukdomar.
I en studie publicerad online 19 april i Natur , laget, ledd av docent i kemi Wei Min, rapporterar utvecklingen av en ny plattform för optisk mikroskopi med drastiskt förbättrad detekteringskänslighet. Dessutom, studien beskriver skapandet av nya molekyler som, när den är ihopkopplad med den nya instrumenten, tillåta samtidig märkning och avbildning av upp till 24 specifika biomolekyler, nästan fem gånger antalet biomolekyler som kan avbildas samtidigt med befintlig teknik.
"I systembiologins era, hur man samtidigt avbildar ett stort antal molekylära arter inuti celler med hög känslighet och specificitet förblir en stor utmaning för optisk mikroskopi, "Min sa." Det som gör vårt arbete nytt och unikt är att det finns två synergistiska bitar - instrumentering och molekyler - som arbetar tillsammans för att bekämpa detta långvariga hinder. Vår plattform har förmågan att omvandla förståelsen för komplexa biologiska system:den stora människocellskartan, metaboliska vägar, funktioner hos olika strukturer i hjärnan, tumörens inre miljö, och makromolekylmontering, för att nämna några stycken."
Alla befintliga metoder för att observera en mängd olika strukturer i levande celler och vävnader har sina egna styrkor, men alla hindras också av grundläggande begränsningar, inte minst är det förekomsten av en "färgbarriär".

Forskare vid Columbia University utvecklade en ny optisk mikroskopi-plattform som kallas elektronisk pre-resonansstimulerad Raman-spridning (epr-SRS) mikroskopi som kombinerar en hög känslighet och selektivitet. Den innovativa tekniken möjliggör avbildning av upp till 24 biomolekylära strukturer åt gången istället för att begränsas av endast fem fluorescerande proteiner. Upphovsman:Nicoletta Barolini, Columbia University
Fluorescensmikroskopi, till exempel, är extremt känslig och, som sådan, är den vanligaste tekniken som används i biologilaboratorier. Mikroskopet tillåter forskare att övervaka cellulära processer i levande system genom att använda proteiner som i stort sett kallas "fluorescerande proteiner" med vanligtvis upp till fem färger. Var och en av de fluorescerande proteinerna har en målstruktur att den tillämpar en "tagg, "eller färg till. De fem fluorescerande proteinerna, eller färger, vanligtvis används för att märka dessa strukturer är BFP (Blue Fluorescent Protein), ECFP (cyan fluorescerande protein), GFP (grönt fluorescerande protein), mVenus (gult fluorescerande protein), och DsRed (rött fluorescerande protein).
Trots sina styrkor, fluorescensmikroskopi hindras av "färgbarriären, "som begränsar forskare till att se högst fem strukturer åt gången eftersom de fluorescerande proteinerna som används avger en rad oskiljbara nyanser som, som ett resultat, faller in i fem stora färgkategorier.
Om en forskare försöker observera alla hundratals strukturer och olika celltyper i ett levande hjärntumörvävnadsprov, till exempel, hon skulle vara begränsad till att bara se upp till fem strukturer åt gången på ett enda vävnadsprov. Om hon ville se mer än de fem, hon skulle behöva rengöra vävnaden från de fluorescerande etiketterna som hon använde för att identifiera och märka de fem senaste strukturerna för att kunna använda samma fluorescerande etiketter för att identifiera ytterligare en uppsättning med upp till fem strukturer. Hon skulle behöva upprepa denna process för varje uppsättning av upp till fem strukturer hon vill se. Det är inte bara att observera högst fem strukturer åt gången arbetskrävande, men vid rengöring av vävnaden, vitala komponenter i vävnaden kan gå förlorade eller skadas.
"Vi vill se dem alla samtidigt för att se hur de fungerar på egen hand och också hur de interagerar med varandra, "sa Lu Wei, huvudförfattare på studien och en postdoktoral forskare i Min lab. "Det finns många komponenter i en biologisk miljö och vi måste kunna se allt samtidigt för att verkligen förstå processerna."

Forskare vid Columbia University utvecklade en ny optisk mikroskopi-plattform som kallas elektronisk pre-resonansstimulerad Raman-spridning (epr-SRS) mikroskopi som kombinerar en hög känslighet och selektivitet. Den innovativa tekniken möjliggör avbildning av upp till 24 biomolekylära strukturer åt gången istället för att begränsas av endast fem fluorescerande proteiner. Upphovsman:Nicoletta Barolini, Columbia University
Förutom fluorescensmikroskopi, det finns för närvarande en mängd olika Raman -mikroskopitekniker som används för att observera levande cell- och vävnadsstrukturer som fungerar genom att synliggöra vibrationer som härrör från karakteristiska kemiska bindningar i strukturer. Traditionell Raman-mikroskopi producerar de högt definierade färgerna som saknar fluorescensmikroskopi, men saknar känsligheten. Som sådan, det kräver en stark, koncentrerad vibrationssignal som bara kan uppnås genom närvaro av miljontals strukturer med samma kemiska bindning. Om signalen från de kemiska bindningarna inte är tillräckligt stark, att visualisera den associerade strukturen är nästan omöjligt.
För att hantera denna utmaning, Min och hans team, inklusive proffs. Virginia Cornish i kemi och Rafael Yuste inom neurovetenskap, drev en ny hybrid av befintliga mikroskopitekniker.
De utvecklade en ny plattform som kallas elektronisk pre-resonansstimulerad Raman-spridning (epr-SRS) mikroskopi som kombinerar det bästa från två världar, samman en hög känslighet och selektivitet. Den innovativa tekniken identifierar, med extrem specificitet, strukturer med betydligt lägre koncentration - istället för miljoner av samma struktur som behövs för att identifiera förekomsten av den strukturen i traditionell Raman -mikroskopi, det nya instrumentet kräver bara 30 för identifiering. Tekniken använder också en ny uppsättning märkningsmolekyler som teamet utformat för att arbeta synergistiskt med den ultramoderna tekniken. Den förstärkta "färgpaletten" av molekyler utökar taggningsförmågan, möjliggör avbildning av upp till 24 strukturer åt gången istället för att begränsas av endast fem fluorescerande färger. Forskarna tror att det finns potential för ytterligare expansion i framtiden.
Teamet har framgångsrikt testat epr-SRS-plattformen i hjärnvävnad. "Vi kunde se de olika cellerna arbeta tillsammans, "Sa Wei." Det är kraften i en större färgpalett. Vi kan nu lysa upp alla dessa olika strukturer i hjärnvävnad samtidigt. I framtiden hoppas vi kunna se dem fungera i realtid. "Hjärnvävnad är inte det enda forskarna föreställer sig att denna teknik används för, tillade hon. "Olika celltyper har olika funktioner, och forskare studerar vanligtvis bara en celltyp åt gången. Med fler färger, vi kan nu börja studera flera celler samtidigt för att observera hur de interagerar och fungerar både på egen hand och tillsammans under friska förhållanden kontra i sjukdomstillstånd. "
Den nya plattformen har många potentiella applikationer, Min sa, tillägger att det är möjligt att tekniken en dag kan användas vid behandling av tumörer som är svåra att döda med tillgängliga läkemedel. "Om vi kan se hur strukturer interagerar i cancerceller, vi kan identifiera sätt att rikta specifika strukturer mer exakt, "sa han." Den här plattformen kan förändras i jakten på att förstå allt som har många komponenter. "