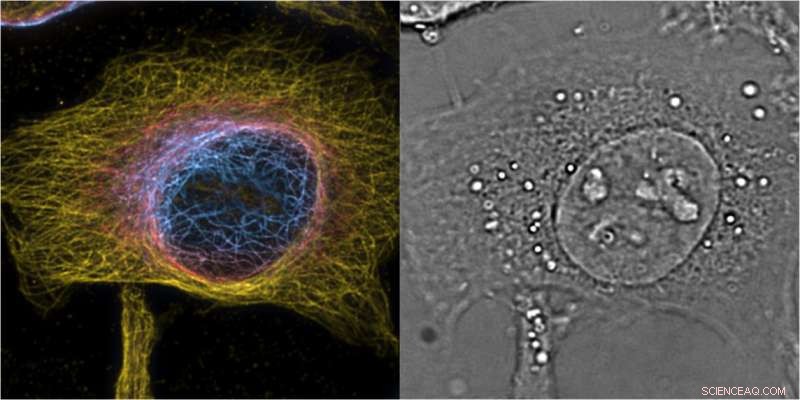
HeLa-cellers maximala intensitetsprojektion av 3D andra ordningens bSOFI av märkta mikrotubuli, färg kodar z-position med en del av den kompletterande 3D-fasbilden som ger cellulär kontext. Kredit:T. Lasser/EPFL
Superupplösningsmikroskopi är en teknik som kan "se" bortom ljusets diffraktion, ger oöverträffade vyer av celler och deras inre strukturer och organeller. Tekniken har väckt ett ökande intresse nyligen, speciellt sedan dess utvecklare vann Nobelpriset i kemi 2014.
Men superupplösningsmikroskopi har en stor begränsning:den erbjuder bara rumslig upplösning. Det kan räcka för statiska prover, som fasta material eller fasta celler, men när det kommer till biologi, saker och ting blir mer komplicerade. Levande celler är mycket dynamiska och beror på en komplex uppsättning biologiska processer som inträffar över sub-sekunders tidsskalor, ständigt förändras. Så om vi ska visualisera och förstå hur levande celler fungerar i hälsa och sjukdom, vi behöver också en hög tid (eller "temporal") upplösning.
Ett team ledd av professor Theo Lasser, chefen för Laboratory of Biomedical Optics (LOB) vid EPFL har nu gjort framsteg för att ta itu med problemet genom att utveckla en teknik som kan utföra både 3-D superupplösningsmikroskopi och snabb 3-D fasavbildning i ett enda instrument. Fasavbildning är en teknik som översätter förändringarna i ljusets fas som orsakas av celler och deras organeller till brytningsindexkartor över själva cellerna.
Den unika plattformen, som kallas ett 4D-mikroskop, kombinerar känsligheten och den höga tidsupplösningen av fasavbildning med specificiteten och den höga rumsliga upplösningen av fluorescensmikroskopi. Forskarna utvecklade en ny algoritm som kan återställa fasinformationen från en hög med ljusfältsbilder tagna med ett klassiskt mikroskop.

PRISM:mikroskopitillägg för att utföra samtidig 3D-avbildning av 8 plan. Kredit:Vytautas Navikas
"Med den här algoritmen, vi presenterar ett nytt sätt att uppnå 3-D kvantitativ fasmikroskopi med ett konventionellt ljusfältsmikroskop, säger Adrien Descloux, en av tidningens huvudförfattare. "Detta möjliggör direkt visualisering och analys av subcellulära strukturer i levande celler utan märkning."
För att uppnå snabb 3D-bild, forskarna specialdesignade ett bilddelande prisma, vilket möjliggör samtidig inspelning av en stapel med åtta z-förskjutna bilder. Detta innebär att mikroskopet kan utföra höghastighets 3-D fasavbildning över en volym på 2,5 μm x 50 μm x 50 μm. Mikroskopets hastighet är i grunden begränsad av dess kameras hastighet; för denna demonstration, teamet kunde avbilda intracellulär dynamik vid upp till 200 Hz. "Med prismat som tillägg, du kan förvandla ett klassiskt mikroskop till en ultrasnabb 3D-bildare, säger Kristin Grussmayer, ytterligare en av tidningens huvudförfattare.
Prismat lämpar sig även för 3D-fluorescensavbildning, som forskarna testade med superupplösning optisk fluktuationsavbildning (SOFI). Denna metod utnyttjar blinkningen av fluorescerande färgämnen för att förbättra 3D-upplösningen genom korrelationsanalys av signalen. Med hjälp av detta, forskarna utförde 3-D superupplösningsavbildning av färgade strukturer i cellerna, och kombinerade det med 3D-etikettfri fasavbildning. De två teknikerna kompletterade varandra väldigt bra, avslöjar fascinerande bilder av den inre arkitekturen, cytoskelett, och organeller också i levande celler över olika tidpunkter.
"Vi är glada över dessa resultat och de möjligheter som denna teknik erbjuder, " säger professor Hilal Lashuel, vars labb vid EPFL slog sig ihop med professor Lasser för att använda den nya tekniken för att studera mekanismerna genom vilka proteinaggregation bidrar till utvecklingen och progressionen av neurodegenerativa sjukdomar, som Parkinsons och Alzheimers. "De tekniska framstegen möjliggjorde högupplöst visualisering av bildandet av patologiska alfa-synukleinaggregat i hippocampus neuroner."
Teamet har döpt den nya mikroskopiplattformen till PRISM, för fasåtervinningsinstrument med superupplösningsmikroskopi. "Vi erbjuder PRISM som ett nytt mikroskopiverktyg och förväntar oss att det snabbt kommer att användas inom life science-gemenskapen för att utöka räckvidden för 3-D höghastighetsavbildning för biologiska undersökningar, ", säger Theo Lasser. "Vi hoppas att det kommer att bli en vanlig arbetshäst för neurovetenskap och biologi."