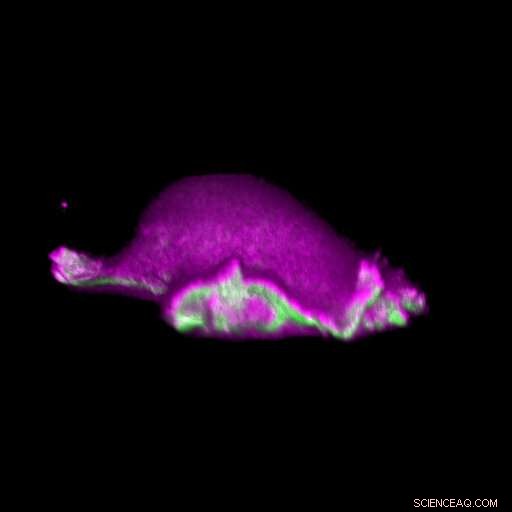
En cell rör sig framåt:I-BAR-proteiner (rosa) ackumuleras vid den plats där dess lamellipodium kröks. Vari, cellen kan lokalt arrangera proteinet aktin (grönt) och generera en lamellipodial cykel. Kredit:Isabell Begemann, Milos Galic
När en enskild cell placeras på en plan yta, den står inte still, men börjar röra på sig. Detta fenomen observerades av den brittiska cellbiologen Michael Abercrombie så länge sedan som 1967. Sedan dess har forskare har blomstrat för att förstå hur celler uppnår denna bedrift. Så mycket är känt:Celler bildar så kallade lamellipodia-cellulära utsprång som kontinuerligt växer och drar ihop sig-för att driva sig mot signaleringstecken som kemiska lockmedel som produceras och utsöndras av andra celler. När sådana externa signaler saknas – som i observationen av Abercrombie – börjar celler aktivt leta efter dem. Genom att göra så, de använder sökmönster som också kan observeras hos hajar, bin eller hundar. De rör sig övergående i en riktning, sluta, vicka på plats en stund, och fortsätt sedan i en annan riktning. Men hur upprätthåller cellernas rörelseriktning under en längre tid?
Forskare vid Cells-in-Motion Cluster of Excellence vid universitetet i Münster (Tyskland) rapporterar nu ett svar på denna fråga. De upptäckte att membrangeometri kan utlösa efterföljande lamellipodiala cykler:Mekaniska krafter orsakar generering av membrankrökning där vissa proteiner som känner igen denna geometri samlas. Dessa proteiner, i tur och ordning, låta cellen bilda lamellipodia. "Krökningen, som genereras under indragning förutbestämmer tillväxten av nästa lamellipodiala cykel. Så här återaktiverar mekanismen sig själv, " förklarar biolog Dr. Milos Galic, junior forskargruppsledare vid Cluster of Excellence, och senior författare till studien. När externa signaler saknas, en cell stannar inte bara och markerar tid - den går en stund åt ett håll och patrullerar effektivt sin miljö. Studien har publicerats i Naturfysik tidning.
Utgångspunkten för studien var en överraskande observation vid analys av mikroskopiska bilder. Forskarna undersökte hur celler bildade lamellipodia och, följaktligen, hur cellernas rörelse och form förändrades. De upptäckte att lamellipodia utvecklades över ett stort antal storlekar och hade mycket olika livslängder.
"I uppgifterna, vi kunde inte känna igen något återkommande mönster i tillväxt och sammandragning av lamellipodia, "säger huvudförfattaren Dr Isabell Begemann, en biolog som genomförde studien som en del av sin doktorsavhandling. Forskarna kunde fastställa att platser för efterföljande lamellipodia -förlängning inträffade varhelst cellmembranet utvecklade en stark krökning. De antog därför att en mekanism kopplad till dessa krökningar kan bestämma kontinuerliga rörelsecykler och, följaktligen, rörelsebeständighet.
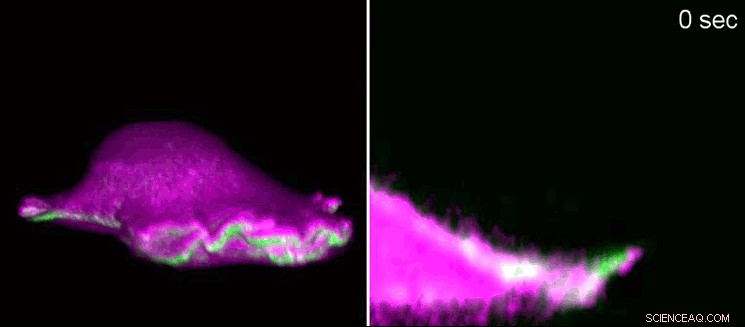
En fibroblast från en mus rör sig framåt med hjälp av ett "lamellipodium". Till vänster, sidvy i 3D, till höger, ett tvärsnitt som zoomar in i lamellpodiet. I-BAR-proteiner (rosa) ackumuleras i början av lamellipodium som ett resultat av cellmembranets krökning. Som en konsekvens, cellen kan lokalt ordna proteinet aktin (grönt) och lamellipodium växer igen. Använda gitter ljusark fluorescensmikroskopi, forskarna visade minutstrukturerna i 3D. Lamellipodia har en höjd av 100 till 200 nanometer. Upphovsman:Isabell Begemann, Milos Galic
Biologer, biokemister och fysiker arbetade nära tillsammans för att undersöka denna idé. De utvecklade först biosensorer för att märka högböjda platser vid cellmembranet, och visualiserade dem med olika medel för högupplöst mikroskopi. För detta ändamål, de kopplade ihop fluorescerande molekyler med så kallade I-BAR-domäner. Dessa är bananformade regioner av proteiner vars positivt laddade sida binder det negativt laddade cellmembranet - men bara när membranet är krökt.
Med fördel av dessa biosensorer, forskarna kunde visa att de krökningskänsliga proteinerna ackumuleras på platser där lamellipodium drar ihop sig. En gång berikad, dessa proteiner inducerar utskjutande krafter i cellen via proteinet aktin, som utlöser utväxt av lamellipodium. I ett nästa steg, forskarna utvecklade en matematisk modell som rekonstruerar mekanismen och simulerade den på datorn med hjälp av olika parameterkombinationer. Att jämföra de förutsägelser som härrör från den matematiska modellen med kompletterande experimentella bilddata stärkte ytterligare resultaten hittills.
Forskarna hittade bevis för närvaron av den identifierade motilitetsmekanismen i cellodlingsmodeller, till exempel, i bindvävsceller härrörande från möss, i mänskliga blodkärlceller från navelsträngen, och även i mänskliga immunceller - dvs. en celltyp som verkligen rör sig fritt inom organismen. Till sist, forskarna ville också veta vilka effekter den föreslagna mekanismen hade på rörlighetsmönstret i en cell.
"Vi nedreglerade I-BAR-proteinerna, gör det möjligt för oss att hacka oss in i cellens självorganiseringssystem, " säger Milos Galic. Utan mekanismen, cellen lyckas fortfarande röra sig, men sökområdet blir väsentligt mindre. Parallellt med denna mekanism, det finns andra maskiner som sammanflätas - men mekanismen har inflytande på cellens motilitetsmönster. Resultaten av studien kan, i framtiden, hjälpa till att svara på grundläggande frågor om processer i organismer som involverar fritt rörliga celler.