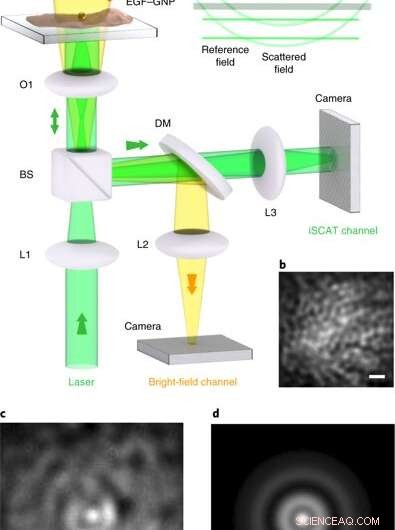
iSCAT -mikroskopi på levande celler. a, Experimentellt arrangemang av iSCAT-mikroskopet för bildceller med levande celler. Celler pläteras i en skål med glasbotten under Leibowitz-medium. (a) mikropipett levererar EGF -BNP -sonderna direkt till cellkulturen, där de specifikt riktar sig mot EGFR -proteinet i cellmembranet. Den ljusa fältbelysningskanalen uppifrån hjälper till att inspektera kulturen men krävs inte för iSCAT-avbildning. L1 – L3, linser; O1, × 100 mål; BS, 90:10 stråldelare; DM, 590 nm kortpassad dikroisk spegel. iSCAT -avbildning utfördes med belysningsintensiteter på 1–8 kW cm − 2, som är kända för att vara livskraftiga för HeLa vid våglängden av intresse. Insats, vågfronter på fälten som bidrar till iSCAT -signalen. (b), En sektion av membranet i HeLa -cellen före märkning, ses via reflektion iSCAT. (c), iSCAT -bild av cellmembranet inklusive en bunden EGF -GNP -sond. (d), PSF extraherad från c. Skalstänger i b – d är 1 μm. Kreditera: Nature Photonics , doi:10.1038/s41566-019-0414-6
Cellfunktioner dikteras av den invecklade rörelsen av proteiner i membran som sträcker sig över en nanometer till mikrometer, inom en tidsram av mikrosekunder till minuter. Dock, denna rika parameter för rymden är otillgänglig med fluorescensmikroskopi, även om det är inom räckhåll för interferometrisk spridning (iSCAT) partikelspårning. Den nya iSCAT -tekniken är, dock, mycket känslig för enstaka och omärkta proteiner, vilket orsakar ospecifik bakgrundsfärgning som en betydande utmaning under cellulär avbildning.
I en nyligen genomförd studie Richard W. Taylor och kollegor vid de tvärvetenskapliga avdelningarna för fysik och biologi i Tyskland utvecklade en ny bildbehandlingsmetod för att övervinna denna svårighet. De använde metoden för att spåra transmembran epidermal tillväxtfaktorreceptor (EGFR) med nanometer skala precision i tre dimensioner (3-D). Tekniken tillät avbildning över mikrosekunder till minuter. Forskarna gav exempel på rörelser och inneslutning i nanoskala med hjälp av metoden för att avbilda allestädes närvarande processer som diffusion i plasmamembran, transport i filopodi och rotationsrörelse under endocytos. Resultaten publiceras nu i Nature Photonics .
Medan stadiga framsteg i fluorescensmikroskopi har gjort det möjligt för forskare att övervaka cellulära händelser i nanometerskala, mycket återstår fortfarande att åstadkomma med avancerade bildsystem. Utmaningarna med fluorescensmikroskopi inträffade på grund av den ändliga utsläppshastigheten för en fluorescerande källa (färgämnesmolekyl eller halvledarkvantpunkt), där för få fotonemissioner under en mycket liten tidsram förhindrade effektiv eller långvarig avbildning. Den centrala svårigheten med spridningsbaserad mikroskopi är relativt nanoskopisk sond, som tävlar mot bakgrundsljudet och ett lågt signal-brus-förhållande (SNR); begränsa bildåtergivningens potential till bara några nanometer i höghastighetsspårningsexperiment.

Raw video av en epidermal tillväxtfaktor-guld-nanopartikel (EGFR – BNP) som diffunderar på ett HeLa-cellmembran. Kreditera: Nature Photonics , doi:10.1038/s41566-019-0414-6
I det nuvarande arbetet, Taylor et al. använde interferometrisk spridning (iSCAT) mikroskopi för att spåra protein i levande cellmembran. Metoden kan visualisera sond-cellinteraktioner för att förstå dynamiken mellan diffusion och lokal topologi. Under försöken, forskarna använde guldnanopartiklar (BNP) för att märka epidermala tillväxtfaktorreceptorer (EGFR) i HeLa -celler. EGFR är typ I transmembranproteiner som kan känna och reagera på extracellulära signaler, vars avvikande signalering är kopplad till en mängd olika sjukdomar. Taylor et al. visade det BNP-märkta proteinet som en 'nano-rover' som kartlade nano-topologin för cellulära funktioner som membranterrasser, filopodia och clathrin strukturer. De gav exempel på subdiffusion och nanoskopisk inneslutningsrörelse av ett protein i 3D vid hög tidsupplösning och långa tidpunkter.
I experimenten, Taylor et al. introducerade epidermal tillväxtfaktor-guld nanopartikel (EGF-GNP) sonder till mikroskopets provkammare med hjälp av en mikropipett för att märka EGFR (epidermala tillväxtfaktorreceptorer) på HeLa-celler och verifierade att proberna stimulerade EGFR. Tidigare studier hade redan visat att sondstorleken kunde påverka lipiddiffusion i syntetmembran, även om de inte påverkade diffusionssättet. Dessutom, i levande celler, molekylär trängsel var försumbar för partiklar lika med eller mindre än 50 nm.
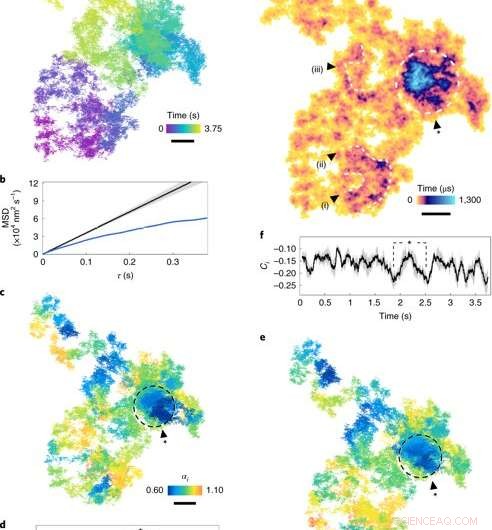
Diffusion på plasmamembranet. (a), En lateral diffusionsbana (17,5 μs exponeringstid, se färgskalan för kronologi). (b), MSD (medelkvadratförskjutning) kontra τ. Den blå kurvan visar MSD för a. Den svarta kurvan simuleras normal diffusion (α =1), med det grå kuvertet som indikerar osäkerheten. (c), Diffusionsexponenten för rullande fönster (färgskala) över banan. Regioner för subdiffusion (α <1) indikeras med mörkare nyanser. (d), αi genom tiden. Den grå skuggningen representerar en genomsnittlig osäkerhet på 7 ± 4%, motsvarande ett 95% konfidensintervall för ett fönster på 100 ms (1, 000 bilder) och τ =250 μs. Punkterna markerade med asterisken motsvarar cirkeln i c. (e), Stegriktningen Ci för rullning av fönster längs banan. (f), Stegriktningen Ci ritade genom tiden, med skuggningen som anger osäkerhet. (g), ATOM ockupationstomt med uppehållstid (färgskala). Fackstorleken motsvarar lokaliseringsfelet. Anmärkningsvärda regioner med utökad ockupation, märkt som slingor och virvlar (i) - (iii), är tecken på ihållande nanoskopiska strukturer. Den slutna regionen representerar en tät fläck av anmärkningsvärd subdiffusion. Skalstänger, 100 nm. Kreditera: Nature Photonics , doi:10.1038/s41566-019-0414-6
Taylor et al. verifierade dessa två konkreta fall i föreliggande arbete genom att jämföra BNP med varierande diametrar vid 48 nm och 20 nm. Forskarna genomförde sedan fluorescerande och biokemiska studier för att föreslå att EGF-belagda BNP aktiverade EGFR-signalering, ungefär som de fritt tillgängliga EGF:erna, vilket indikerar att etiketten inte hindrade biologiska funktioner. För att övervinna bakgrundsbrus relaterat till molekylär avbildning implementerade forskarna en ny algoritm, som extraherade hela iSCAT-punkts spridningsfunktionen (iSCAT-PSF) direkt från varje ram för tydlighetens skull. Eftersom befintliga tekniker inte kan visualisera funktioner med hög rumslig och tidsmässig upplösning, många detaljer om intracellulär aktivitet återstår att debattera. Som svar, den nya metoden av Taylor et al. erbjöd en mängd dynamiska heterogeniteter i 3D för att belysa intracellulär proteinrörelse.
Forskarna studerade först kvantitativt subdiffusion i plasmamembranet genom att överväga ett 2-D-exempel på EGFR-resan på membranet i en levande HeLa-cell. För detta, de beräknade den genomsnittliga kvadratförskjutningen (MSD) för hela rörelsebanan. Taylor et al. behövde inte göra antaganden om diffusionens natur eller dess geografiska landskap under beräkningen. De mätte förekomsten av biologiska diffraktiva barriärer och instängningar genom att observera graden av riktningskorrelation mellan två vektorsteg över ett tidsintervall.

Diffusion på ett filopodium. Kreditera: Nature Photonics , doi:10.1038/s41566-019-0414-6
Forskarna bedömde sedan populariteten för varje banapixel i rymden genom att införa en ackumulerad tidsmässig beläggningskarta (ATOM). I denna teknik, de delade banans sidoplan i fack i nanometerstorlek och räknade förekomsten av partikeln i varje kärl. Resultaten indikerade arrangemanget av nanostrukturer i slingor och virvlar inom en minimal livstid på 250 nanosekunder (5000 bilder) för att potentiellt skildra ett pre-endocytiskt steg. Totalt, de simulerade observationerna visade hur proteindiffusion påverkades av cellens understruktur.
ISCAT -mikroskopitekniken gjorde det möjligt för forskare att spela in effekter under en mycket lång tid, som de använde tillsammans med 3D-avbildningskapacitet för att följa EGFR på ett filopodium. Filopodierna är biologiskt stavliknande cellulära utsprång som innehåller buntar aktinfilament med upp till 100 till 300 nm i diameter och 100 µm i längd. Nanostrukturerna kan känna mekaniska stimuli för kemoattraktion eller avstötning i den cellulära mikromiljön samtidigt som de ger platser för cellfästning. Ligandbindning och EFGR -aktivering på filopodia inträffade vid låga koncentrationer av EGF, följt av dess associering med aktinfilament och retrograd transport av EFGR till cellkroppen.
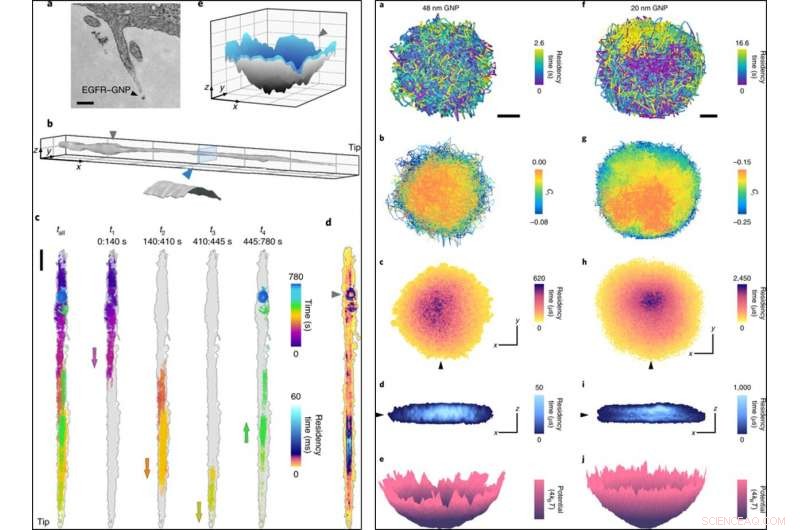
VÄNSTER:(a) En TEM -bild (transmissionselektronmikroskop) av ett filopodium inklusive en EGFR – BNI. (b), En filopodiumyta rekonstruerad från 780, 000 banor med ett lokaliseringsfel på σx, y =2 nm registrerat vid 1, 000 fps. Insats, tvärsnittsskiva som visar en cylindrisk yta med diameter 150 nm efter att ha tagit hänsyn till storleken på BNP. (c), En rå 13 min bana (vänster) uppdelad i fyra efterföljande bitar som avslöjar resan till och från spetsen, med pilar som markerar nätrörelsens riktning. (d), En ATOM -tomt på c, korrigerad för filopodiumdrift. (e), En ytinterpolering från de sista 80 -talet. Den ringliknande inneslutningen i slutfasen (markerad med en triangel) är en 3D-grop. Skalstaplarna är 200 nm (a), 1 μm (x, y) och 200 nm (z) (b), 1, 000 nm (c) och 100 nm (x, y) och 50 nm (z) (e). HÖGER:(a), En lateral bana av en 48 nm GNP -sond. Skala, 100 nm. Ett lägre tidsurval av denna inneslutning skulle ha underskattat gränsens omfattning. (b), Ci i banan (med en tidsfördröjning på fem bildrutor), som visar delvis hindrad diffusion med en benägenhet för friare diffusion i mitten. (c), En ATOM -tomt av en. (d), Ett snitt genom 3D-ATOM-diagrammet längs linjen i den svarta triangeln i c visar att beläggning gynnar en innersta diskliknande region. Axlarna betecknar 100 nm i både c och d. (e), Omvandling av den tidsmässiga 2D -ockupationen från c till en effektiv potentiell energidistribution. (f – j), Motsvarar a – e, men för en 20 nm GNP -sond. Kreditera: Nature Photonics , doi:10.1038/s41566-019-0414-6
Forskarna fick därmed insikt om de nanoskopiska detaljerna om diffusion längs filopodiet och registrerade data under 13 minuter. De analyserade 3D-banan för att skapa filopodium-topografin med guldnanopartiklar som en 'nano-rover' och kartlade ytstrukturen för cellulära strukturer för djupare undersökning. De ritade banan ATOM (ackumulerad temporal beläggningskarta) och fann att 3D-representationen överensstämde med det biologiska steget av pre-endocytisk membraninvaginering.
Höghastighetsmikroskopitekniker som iSCAT är nödvändiga för att få högupplöst tidsinformation och förhindra suddiga effekter under nanopartikellokaliseringsbaserad avbildning. Forskarna demonstrerade denna funktion genom att spela in begränsad diffusion vid 30, 000 fps (bildrutor per sekund) med 48 nm och 20 nm GNP. De följde experimenten med ultrahöghastighets 3D-spårning av proteiner vid 66, 000 fps med en kort exponeringstid på 10 µs inom en tidsperiod på 3,5 sekunder. Snabb iSCAT mikroskopi avbildning gav ytterligare bevis för att avslöja de invecklade egenskaperna hos endocytiska händelser i förhållande till klatrinförmedlad endocytos i HeLa-celler när de simulerades av låga koncentrationer av EGF.
På det här sättet, Taylor et al. noterade att den nya tekniken troget kunde spela in nano-topografisk information. Resultaten matchade observationerna som registrerats med transmissionselektronmikroskopi (TEM) utan signifikanta skillnader i sondstorleksreduktion från 48 nm till 20 nm, samtidigt som den ger nya insikter. De nya insikterna inkluderade detaljer om subdiffusion, nanoskopisk inneslutning, 3-D konturer av filopodia och clathrin strukturer på nanoskala. Forskarna tänker kombinera iSCAT med in situ superupplöst fluorescensmikroskopi för att förstå proteinernas banor, virus och andra nanoskopiska biologiska enheter. Taylor et al. syftar till att avancera metoderna för bildanalys för att spåra BNP mindre än 20 nm i framtiden och tror att den nya tekniken och ytterligare optimering kommer att göra det möjligt för dem att specifikt förstå livscykeln för virus utan att använda en extern etikett för spårning.
© 2019 Science X Network