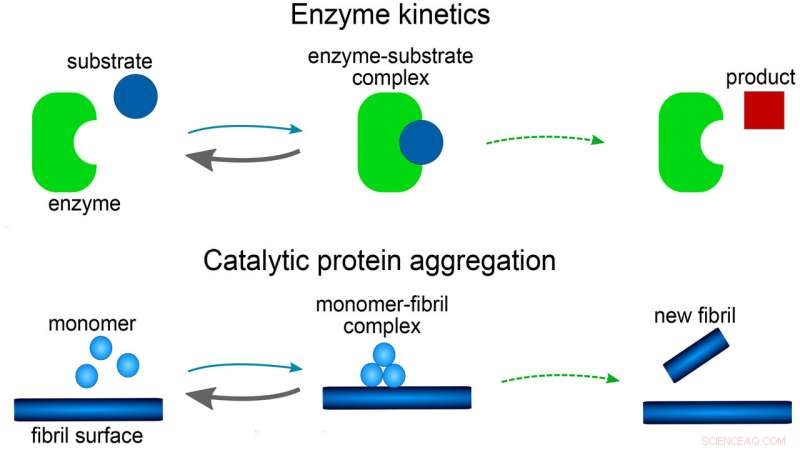
Jämförelse av proteinaggregation med enzymkinetik. Kredit:Alexander J. Dear
Amyloider är aggregat som består av staplar av tusentals proteiner som är tätt sammanbundna. Deras bildning är involverad i flera utbredda sjukdomar, inklusive Alzheimers sjukdom och typ II-diabetes.
I veckans Journal of Chemical Physics forskare rapporterar om en matematisk modell för bildandet av amyloidfibriller. Modellen belyser hur aggregeringsprocessen kan ske på ett katalytiskt sätt, något som tidigare inte har förståtts väl.
Utredarna tillämpade sin modell på aggregeringen av ett specifikt protein associerat med Alzheimers, Ab40. Resultaten visar att initieringen av aggregeringsprocessen för Ab40?-fibriller vanligtvis sker vid gränssnitt, såsom nära ytan av en flytande lösning eller glasväggen i ett provrör. Detta har viktiga konsekvenser för tolkningen av laboratoriedata som används vid studier av Alzheimers och andra sjukdomar.
Modellen består av en uppsättning matematiska ekvationer, känd som hastighetsekvationer, som beskriver hur proteinaggregatkoncentrationer förändras över tiden. Varje reaktionssteg i modellen har visat sig vara analogt med de i reaktioner som involverar enzymer. Enzymets roll spelas av antingen spetsen eller sidan av en växande fiber eller, eventuellt, en yta av reaktionskärlet.
Utredarna fann att den matematiska formen av deras modell var relaterad till de berömda Michaelis-Menten-ekvationerna, publicerades först 1913 för att beskriva hastigheten för enzymreaktioner. Den har en mycket enklare matematisk form än alla tidigare modeller som används för amyloidbildning och har den ytterligare fördelen att ekvationerna kan lösas för hand, utan behov av datorsimuleringar.
"Vi förväntar oss att den metod som utvecklats i detta dokument kommer att underbygga framtida ansträngningar för att modellera nya amyloidbildningsfenomen, ", sa medförfattaren Alexander Dear.
En av nyckelfunktionerna i den matematiska lösning som hittats för ekvationer av Michaelis-Menten-typ är ett fenomen som kallas mättnad. När mättnad inträffar, de katalytiska platserna blir helt upptagna vid höga proteinkoncentrationer. När det gäller Ab40-studierna, mättnad visar också att processen som initierar aggregation involverar en yta, såsom väggen i ett provrör.
Även om slutsatserna inte direkt gäller kroppen själv, medförfattaren Tuomas Knowles sa, "Detta arbete kommer att vara centralt för att underlätta studiet av amyloidbildning i närvaro av andra arter som finns i kroppsvätskor."
Medförfattaren Sara Linse sa, "Detta arbete tar analysen av experimentella data till en ny nivå som kommer att vara avgörande för att härleda potenta hämmare av amyloidbildning."