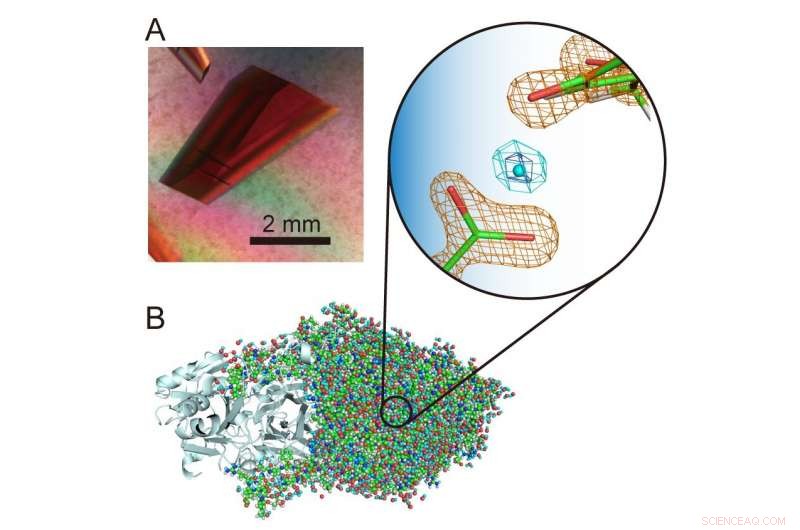
(A) Extra stor kristall av ett kopparaminoxidas. (B) Tredimensionell struktur av kopparaminoxidaset inklusive väteatomer. En ovanlig "leviterad" proton presenteras i mitten av förstorad vy. Upphovsman:Osaka University
Att förstå beteendet hos proteiner och enzymer är nyckeln till att låsa upp biologiska processers hemligheter. Atomstrukturerna hos proteiner undersöks i allmänhet med användning av röntgenkristallografi; dock, den exakta informationen för väteatomer och protoner (vätejoner) är vanligtvis ouppnåelig. Nu ett team inklusive Osaka University, Osaka Medical College, Nationella institut för kvant- och radiologisk vetenskap och teknik, Ibaraki universitet, och University of Tsukuba har använt neutronkristallografi för att avslöja högupplösta strukturella detaljer om ett mycket stort oxidasprotein. Deras resultat publiceras i PNAS .
De väteatomer och protoner som utgör ungefär hälften av atomerna i proteiner och enzymer spelar ofta avgörande roller i de jobb som dessa biomolekyler utför; dock, deras exakta positioner är svåra att identifiera på grund av deras lilla storlek. Det vanligaste tillvägagångssättet för att räkna ut strukturen hos ett protein är att rikta en stråle av högenergiröntgenstrålar mot en proteinkristall och analysera diffraktionsmönstret som är resultatet av röntgenstrålarnas interaktioner med atomernas elektroner i strukturera. Tyvärr, Röntgenstrålar interagerar inte starkt med väteatomer eller protoner, som har låg eller ingen elektrontäthet, vilket gör dem svåra att "se".
En lösning är att applicera en neutronstråle på kristallen istället för röntgenstrålar. Neutroner interagerar med atomernas kärnor i deras väg, inklusive väteatomer och protoner, trots att de är små. Diffraktionsmönstren som följer av dessa interaktioner registreras efter att neutronstrålen har passerat genom kristallen, och avkodas till de exakta platserna för kärnorna, inklusive vätekärnorna.
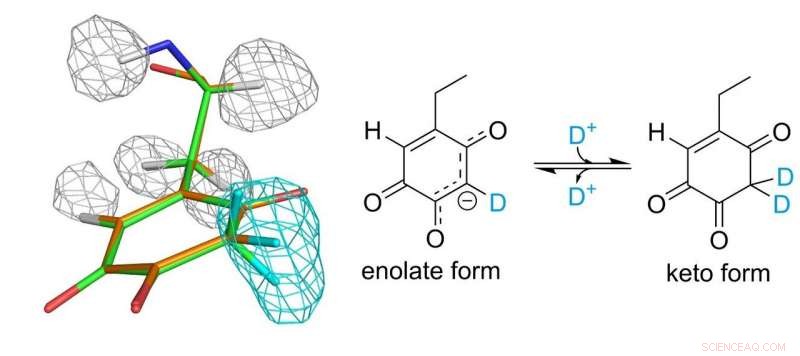
Struktur av topakinon -kofaktor. Grå och ljusblå maskor representerar densiteter av väte- och deuteriumatomer, respektive. Upphovsman:Osaka University
"Väteatomer och protoner är särskilt intressanta komponenter i enzymstrukturer eftersom de kan uppvisa kvantbeteenden som nyligen har visat sig vara avgörande för enzymfunktionen. Det är därför viktigt att exakt bestämma sina platser i proteinstrukturen för att upptäcka vad som händer. , "förklarar motsvarande författare Toshihide Okajima." Med hjälp av neutronkristallografi, vi kunde bestämma strukturen för ett bakteriellt kopparaminoxidas med en molekylvikt av 70, 600 - vilket är extremt stort för neutronkristallografi och avsevärt överstiger tidigare registrerade molekylmassor - och lokaliserar fortfarande exakt väteatomer och protoner i strukturen. En ovanlig "leviterad" proton observerades mellan en kofaktor, topa kinon, och en aminosyrarest strikt konserverad i denna klass av enzymer. "
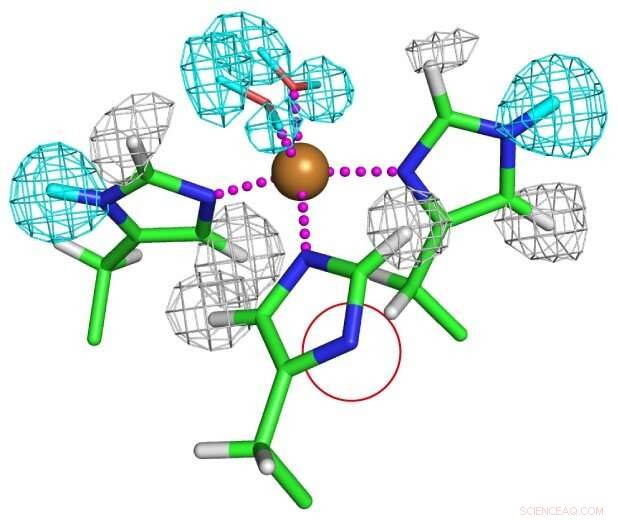
Protonationstillstånd för kopparkoordinerade histidinrester. En av histidinresterna deprotoneras helt som visas i en röd cirkel för att bilda en ovanlig imidazolatanjon. Upphovsman:Osaka University
Topakinon -kofaktorn kovalent bunden till enzymet spelar en väsentlig roll i den katalytiska funktionen. Forskarna kunde äntligen upprätta en fullständig bild av topakinon 30 år efter dess upptäckt som en protein-härledd kofaktor. De fann att kofaktorn faktiskt existerar i jämvikt mellan två olika former.
"Enzymaktiva platser - där reaktionerna äger rum - kan ge oss mycket information och inspiration om vi fullt ut kan förstå vad som händer, "Okajima förklarar." Vår demonstration av att använda neutronkristallografi för att avslöja protonkvanteffekter lovar att vara mycket användbar för många forskare som studerar enzymer och deras mekanismer. "