Oavsett om det är i form av frost eller en slät, genomskinlig isbit, fäster is spontant och till och med ganska starkt på många fasta ytor. Men som vilken vårdslös person som helst som har sladdat på en vintertrottoar kan vittna om kan is också vara mycket halt. Faktum är att is kan vara både klibbig och hala.
Denna mångsidighet har länge förbryllat forskare. Till att börja med har de försökt knäcka hemligheten bakom isens hala i mer än 150 år. Bland dem har varit kända fysiker som Lord Kelvin och Michael Faraday. Den senare, mer känd för sitt arbete inom elektromagnetism, var den första som föreställde sig närvaron av ett tunt lager flytande vatten som täcker is, även långt under 0°C. Vid den tiden resonerade han att kontakten av ett fast föremål mot ytskiktet fick det att fungera som ett smörjmedel, vilket kraftigt minskade friktionen på isen. Förekomsten av detta vätskeskikt bekräftades av experiment mer än ett sekel senare.
För att svara på frågan "Varför är isen halt?" vi måste först förstå hur detta tunna lager av flytande vatten på den frusna ytan har kommit till.
Eftersom vatten är tätare i sin flytande fas än i sitt isiga tillstånd, trodde man länge att isytans smältning var kopplad till övertryck - till exempel på grund av skridskoåkarens vikt på den lilla yta som låg under henne eller hans skridskor. Genom att komprimera isen ytterligare skulle skridskoåkaren få den att smälta, vilket gör den flytande och hal.
Andra tror att värme frigörs genom friktion när föremålet rör sig över isen, vilket får ytan att smälta. Ungefär som när du gnuggar händerna mot varandra för att värma dem, när du gnider ett fast ämne mot ett annat, värms de upp.
Dessa två mekanismer förklarar dock inte varför isen förblir halt under -20°C. Vid sådana temperaturer skulle det krävas avsevärt tryck – ungefär 500 gånger det som en skridsko utövar – för att få den att smälta.
På 1960-talet, mer än ett sekel efter Faraday, gjorde J.W. Telford och J.S. Turner drog långsamt en tråd genom "kall" is (under -20°C) för att avslöja att den förblev halt ner till -35°C, då värmen som frigjordes av friktion inte längre räckte för att smälta isen.
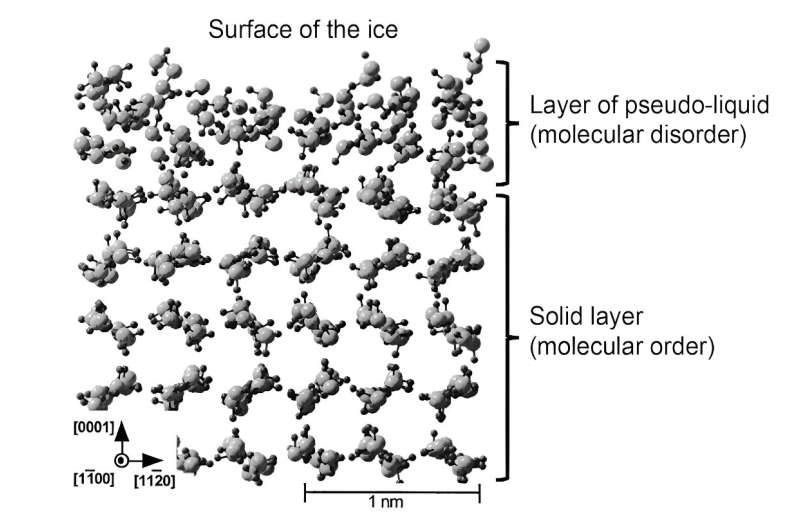
Det var bara omkring ett sekel efter Faradays intuition som vi kunde demonstrera detta vätskeskikt indirekt genom att mäta egenskaperna hos isytan och inte volymen – i detta fall dess egenskaper för absorption av kolväteångor, som är ganska jämförbara med egenskaperna hos isens yta. flytande vatten!
Tekniker som involverar proton- eller röntgenspridning, som vanligtvis används för att studera strukturen hos kristaller, har gjort det möjligt att uppskatta tjockleken till mellan ett och flera hundra nanometer. Vissa studier har till och med föreslagit att denna tjocklek avviker när temperaturen närmar sig 0°C.
På senare tid har simuleringar gjort det möjligt att bättre representera strukturen av detta vätskeskikt. Därefter hänvisades detta skikt till som "pseudo-vätska" eller "kvasivätska" för att skilja det från den verkliga vätskefasen. Sådant teoretiskt arbete har visat att i detta ytskikt kan molekylerna röra sig mer fritt, vilket bekräftar dess roll som smörjmedel. Ändå är den molekylära strukturen inte exakt densamma som den för flytande vatten, vilket får konsekvenser för de mekaniska egenskaperna hos detta pseudo-vätskeskikt.
En nyligen genomförd studie visade ett starkt samband mellan molekylernas individuella rörlighet och den makroskopiska friktionskoefficienten (ju lägre koefficient, desto lättare är det att glida), vilket tyder på att det inte så mycket är tjockleken på lagret som spelar roll för glidningen. utan snarare den individuella rörelsen av molekylerna. Minimivärdet för friktionskoefficienten mäts vid -7°C, känd som den optimala temperaturen för skidåkare och skridskoåkare.
Annan forskning gick till hjärtat av pseudo-vätskeskiktet med hjälp av en nano-sond, spetsen på ett atomkraftmikroskop. Genom att vibrera denna spets kopplad till en extremt exakt kraftsensor, mäta friktionen mellan spetsen och vätskan i lagret, mätte författarna att denna vätska kan vara 50 gånger mer trögflytande än flytande vatten, och att den också har elasticitet (en egenskap mer förknippad med det fasta tillståndet). Denna viskositet liknar den hos dina ätliga oljor, vilket gör det pseudo-vätskelagret till ett utmärkt smörjmedel.
För att sammanfatta:is glider eftersom ett vätskeskikt på cirka 1 till 100 nanometer tjockt bildas på dess yta. Dess mekaniska egenskaper (viskositet, elasticitet), som skiljer sig från flytande vatten, och rörligheten hos molekylerna som utgör det, som är mycket större än för fast is, ger det dess exceptionella smörjande egenskaper.
Isens klibbighet fortsätter dock att förvirra forskare, trots 70 år av experiment. Under det senare har forskare tenderat att använda sig av ett ganska enkelt kit:en kolv som är ansluten till kraftsensorn trycker på ett isblock som själv sitter fast vid ett fast föremål. När isbiten går sönder blir kraften som registreras av sensorn plötsligt noll, och det maximala värdet innan denna utbrytning mäts. Men dessa resultat har visat ibland motsägelsefulla trender och en ganska stor spridning.
En nyligen genomförd granskning av ämnet drog slutsatsen att vidhäftningskraften hos is "beror inte bara på den kemiska sammansättningen, ytråheten, mekaniska och termiska egenskaper hos substratet [utan] också kritiskt på temperaturen och till och med på den experimentella enheten för att mäta vidhäftning. ."
För att vara lite mer exakt, när vi utforskar litteraturen om ämnet under de senaste 60 åren, noterar vi att styrkan med vilken is fastnar på ett fast ämne beror starkt på temperaturen i ett intervall mellan -20°C och 0°C ( is fastnar hårdare på ett kallare fast ämne). När det gäller ytjämnhetens roll är den ambivalent:för vissa fasta ämnen (särskilt metaller) fastnar isen starkare på ett grövre underlag, medan det på vissa plaster är tvärtom...
Slutligen, på kemisk nivå, kan flytande vatten spridas bättre på vissa ytor än andra. Vatten sprids till exempel väldigt bra på rent glas, medan vissa ytor är hydrofoba, som teflon.
En nyligen genomförd studie har visat att ju mer vatten i flytande tillstånd sprider sig över ytan av ett fast ämne, desto mer is kommer att fästa vid detta fasta material. Omvänt kommer en yta med liten affinitet för flytande vatten också att ha liten vidhäftning för is.
Varför detta förhållande mellan spridning av vatten och vidhäftning av is? För det första, för att is ska fästa vid ett kallt fast ämne, måste vatten i flytande tillstånd ha kunnat frysa vid kontakt med det fasta ämnet. Här är ett enkelt experiment som alla kan göra:
Vad kan vi dra slutsatsen? Intuitivt, ju större affinitet vattnet har för ytan, desto lättare sipprar det flytande vattnet in i grovheten och luckorna på ytan av det fasta ämnet, vilket ökar kontaktytan mellan det och isen efter stelnandet, vilket konsoliderar vidhäftningen. Detta experiment visar också rollen av flytande vatten som ett lim. När du använder ett konventionellt lim – säg flytande lim – för att foga samman två delar, är det när delarna stelnar (genom avdunstning av ett lösningsmedel i limmet) som den starka, definitiva vidhäftningen sker. Samma sak händer när flytande vatten svalnar vid kontakt med en kall fast substans och stelnar. Lagret av fruset vatten spelar då rollen som ett av de fasta ämnena.
Vi kan inte förklara isvidhäftningen i detalj, men vi kan försöka minska dess styrka. Idén att använda vattenavvisande behandlingar har naturligt vuxit fram, men dessa behandlingar är inte särskilt robusta över tid och kan ha motsatt effekt av vad som var tänkt. Mer lovande lösningar innebär att man sprider ett tunt lager olja eller en hydrogel över ytan, men det finns fortfarande problem med dessa lagers stabilitet över stora ytor.
Ett annat tillvägagångssätt är att använda aktiva avisningsmetoder. En sådan teknik är ytultraljud, som genererar "mikrojordbävningar" på den fasta ytan och kan få isen att bryta sig loss. Vi studerar för närvarande denna metod i MSC-laboratoriet.
Tillhandahålls av The Conversation
Den här artikeln är återpublicerad från The Conversation under en Creative Commons-licens. Läs originalartikeln. 