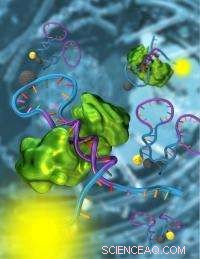
En strukturomkopplande nanosensor gjord av DNA (blått och lila) detekterar en specifik transkriptionsfaktor (grön). Genom att använda dessa nanosensorer, ett team av forskare från UCSB har visat detektering av transkriptionsfaktorer direkt i cellulära extrakt. Forskarna tror att deras strategier kommer att tillåta biologer att övervaka aktiviteten hos tusentals transkriptionsfaktorer, leder till en bättre förståelse av mekanismerna bakom celldelning och utveckling. Kredit:Peter Allen
Sensorer gjorda av anpassade DNA-molekyler kan användas för att anpassa cancerbehandlingar och övervaka kvaliteten på stamceller, enligt ett internationellt team av forskare ledda av forskare vid UC Santa Barbara och University of Rome Tor Vergata.
De nya nanosensorerna kan snabbt upptäcka en bred klass av proteiner som kallas transkriptionsfaktorer, som fungerar som livets huvudkontrollbrytare. Forskningen beskrivs i en artikel publicerad i Journal of the American Chemical Society .
"Våra cellers öde styrs av tusentals olika proteiner, kallas transkriptionsfaktorer, sa Alexis Vallée-Bélisle, en postdoktor vid UCSB:s institution för kemi och biokemi, som ledde studien. "Dessa proteiners roll är att läsa genomet och översätta det till instruktioner för syntesen av de olika molekylerna som utgör och kontrollerar cellen. Transkriptionsfaktorer fungerar lite som "inställningarna" för våra celler, precis som inställningarna på våra telefoner eller datorer. Vad våra sensorer gör är att läsa dessa inställningar."
När forskare tar stamceller och förvandlar dem till specialiserade celler, de gör det genom att ändra nivåerna av några få transkriptionsfaktorer, han förklarade. Denna process kallas cellomprogrammering. "Våra sensorer övervakar transkriptionsfaktoraktiviteter, och kan användas för att se till att stamceller har omprogrammerats ordentligt, ", sa Vallée-Bélisle. "De kan också användas för att bestämma vilka transkriptionsfaktorer som aktiveras eller undertrycks i en patients cancerceller, vilket gör det möjligt för läkare att använda rätt kombination av läkemedel för varje patient."
Andrew Bonham, en postdoktor vid UCSB och medförfattare till studien, förklarade att många laboratorier har uppfunnit sätt att läsa transkriptionsfaktorer; dock, det här lagets tillvägagångssätt är mycket snabbt och bekvämt. "I de flesta labb, forskare spenderar timmar på att extrahera proteinerna från celler innan de analyserar dem, " sa Bonham. "Med de nya sensorerna, vi mosar bara ihop cellerna, sätt in sensorerna, och mät nivån av fluorescens i provet."
Denna internationella forskningsinsats –– organiserad av seniorförfattarna Kevin Plaxco, professor vid UCSB:s institution för kemi och biokemi, och Francesco Ricci, professor vid universitetet i Rom, Tor Vergata –– började när Ricci insåg att all information som behövs för att upptäcka transkriptionsfaktoraktiviteter redan är krypterad i det mänskliga genomet, och kan användas för att bygga sensorer. "Vid aktivering, dessa tusentals olika transkriptionsfaktorer binder till sin egen specifika mål-DNA-sekvens, ", sa Ricci. "Vi använder dessa sekvenser som utgångspunkt för att bygga våra nya nanosensorer."
Det viktigaste genombrottet bakom denna nya teknik kom från studier av de naturliga biosensorerna inuti celler. "Alla varelser, från bakterier till människor, övervaka deras miljöer med hjälp av "biomolekylära switchar" – formförändrande molekyler gjorda av RNA eller proteiner, " sa Plaxco. "Till exempel, i våra bihålor, det finns miljontals receptorproteiner som upptäcker olika luktmolekyler genom att byta från ett "av-läge" till ett "på-tillstånd". Det fina med dessa omkopplare är att de är tillräckligt små för att fungera inuti en cell, och tillräckligt specifik för att fungera i de mycket komplexa miljöer som finns där."
Inspirerad av effektiviteten hos dessa naturliga nanosensorer, forskargruppen samarbetade med Norbert Reich, också professor vid UCSB:s institution för kemi och biokemi, att bygga syntetiska switchande nanosensorer med hjälp av DNA, snarare än proteiner eller RNA.
Specifikt, teamet omkonstruerade tre naturligt förekommande DNA-sekvenser, var och en känner igen en annan transkriptionsfaktor, till molekylära switchar som blir fluorescerande när de binder till sina avsedda mål. Med hjälp av dessa sensorer i nanometerskala, forskarna kunde fastställa transkriptionsfaktoraktivitet direkt i cellulära extrakt genom att helt enkelt mäta deras fluorescensnivå.
Forskarna tror att denna strategi i slutändan kommer att tillåta biologer att övervaka aktiveringen av tusentals transkriptionsfaktorer, leder till en bättre förståelse av mekanismerna bakom celldelning och utveckling. "Alternativt eftersom dessa nanosensorer arbetar direkt i biologiska prover, vi tror också att de kan användas för att screena och testa nya läkemedel som till exempel, hämma transkriptionsfaktorbindande aktivitet som är ansvarig för tillväxten av tumörceller, sa Plaxco.