
Denna överföringselektronmikrograf visar en solid-state nanopore:Den vita cirkeln i mitten av bilden. Den annars fläckiga strukturen är resultatet av den polykristallina naturen hos en guldfilm som avdunstades på kiselnitridmembranet (som inte syns). Upphovsman:Rant group, TU Muenchen Upphovsrätt TU Muenchen
En ny typ av sensor, baserat på porer i nanometerskala i ett halvledarmembran, är ett steg närmare praktisk användning i applikationer som att analysera proteininnehållet i en enda cell. Forskare som är banbrytande enmolekylära nanoporesensorteknik vid Technische Universität München (TUM) har visat sin potential genom en rad experiment under de senaste åren. Nu, i samarbete med biokemister vid Goethe University Frankfurt, de har kunnat avancera denna ansträngning förbi det som hade varit en stickpunkt:att förbättra sensorns selektivitet samtidigt som den bibehåller dess känslighet för enskilda molekyler. De rapporterar de senaste resultaten i Naturnanoteknik .
Forskning som syftar till att tillverka och kontrollera diagnostiska enheter i skala med biologiska molekyler har avancerat till den punkt där flera olika tillvägagångssätt ses som konkurrenskraftiga för praktisk tillämpning inom en relativt nära framtid. Strävan är inte att skapa en universell, bredspektrumsensor, utan snarare en teknik för att detektera och identifiera enskilda molekyler av specifikt riktade proteiner - utan att behöva modifiera dem genom att lägga till biokemiska "etiketter". Sådan teknik kan användas, till exempel, att påskynda översättningen av insikter från genomik till arbetskunskap om proteomik. Detta är av avgörande betydelse för medicinsk och farmaceutisk forskning samt för mer grundläggande biologiska studier. En annan ofta nämnd potentiell tillämpning är upptäckt av biologiska krigföringsmedel.
En av de mest lovande tillvägagångssätten är att konstruera en molekylär "kontrollpunkt, "en övervakad passage mellan två saltlösningar åtskilda av ett artificiellt membran. Denna så kallade nanopor är dimensionerad och formad så att molekyler måste passera en i taget. En molekyls närvaro i vägen ger mätbara förändringar i elektrisk konduktivitet över nanoporen, och ytterligare förfiningar kan finjustera en sådan detektor för att göra den till en mycket specifik "identitetskontroll" för riktade molekyler. Vad München-Frankfurt-samarbetet har möjliggjort är en robust och reversibel metod för att göra denna finjustering:att utrusta en oorganisk nanoporesensor med biologisk funktionalitet genom att förankra molekylära receptorer inuti den. Teamen leddes av Dr. Ulrich Rant, från TUM:s Walter Schottky Institute och TUM Institute for Advanced Study, och professor Dr. Robert Tampé från Institute of Biochemistry vid Goethe University Frankfurt och Cluster of Excellence Frankfurt (CEF) Makromolekylära komplex.
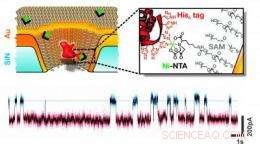
Denna schematiska illustration visar en guldbelagd fast nanopor som är kemiskt modifierad med en enda receptor som kan binda proteinmolekyler med en specifik uppsättning aminosyrarester. Ett exemplariskt ström-mot-tid-spår visar den övergående bindningen av enstaka proteiner. Upphovsman:Rant group, TU Muenchen, Upphovsrätt TU Muenchen.
"Vad jag tycker är fantastiskt med nanoporer, "Rant säger, "är deras kostnadseffektivitet:Du kan redan köra enkelmolekylförsök med utrustning värd bara ett par tusen euro. Om tekniken kommercialiseras ytterligare, Jag är säker på att instrument kan säljas till priset av en persondator, möjligen låta människor upptäcka enstaka molekyler hemma. "
Tillverkningen av dessa experimentella anordningar började med ett substrat av kiselnitrid bara 50 nanometer tjockt; således var membranet bokstavligen ett halvledarchip (dock inte, självklart, en integrerad krets). Standardverktyg för mikroelektronikindustrin, elektronstråle litografi och reaktiv jonetsning, användes för att genomborra kiselnitridmembranet med nanoporer 20 till 50 nm i diameter. Ångavsättning användes för att belägga porerna med titan och guld, och metallen fick i sin tur en självmonterad kemisk beläggning med ett molekylskikt tjockt. De resulterande nanoporerna hade en avsmalnande konisk form med en diameter vid den smala änden av cirka 25 nm; förankrade i ytskiktet var ett litet antal biokemiska receptorer utformade för att fånga upp och immobilisera proteinet som skulle ge sensorn dess biologiska funktionalitet. För dessa experiment, chipsen monterades i en mätkammare med en elektrolytlösning på vardera sidan; proteinmolekyler tillsatta till ena sidan av kammaren tvingades genom nanoporen med en elektrisk laddning. Spår av förändringar i elektrisk ström gav mätningar i realtid av enstaka molekyler när de passerade genom nanoporerna-eller dröjde kvar medan de interagerade med det immobiliserade proteinet-och dessa data gav i sin tur positiv identifiering av målmolekylerna.

Denna konstnärs återgivning illustrerar hur enstaka proteiner sonderas med en artificiellt konstruerad nanopor i ett metalliserat solid state-membran. Aprimärt protein (mörkrött) förankrat i poren binder övergående en IgG -antikropp (ljusröd) som passerar genom poren. Interaktionstiden kan mätas elektriskt (ett exemplifierande ström-mot-tid-spår visas högst upp på bilden); detta avslöjar antikroppens biologiska funktion. En matta av självmonterade molekyler (vita hårstrån) används för att belägga guldporväggarna, gör ytan biologiskt inert. Upphovsman:Christof Hohmann, Excellence Cluster Nanosystems Initiative Munich (NIM), copyright NIM
Forskarna kunde upptäcka rekombinanta histidintaggade proteiner, och även att skilja mellan subklasser av naturliga IgG -antikroppar (från råttor och hamstrar). Förr, denna selektivitetsnivå kunde endast uppnås på bekostnad av enmolekylkänslighet. Resultaten rapporteras i Naturnanoteknik visa att detta hinder kan övervinnas, och mer - att tillvägagångssättet är extremt mångsidigt. Som Rant förklarar, "Metoden vi använde för att förankra enstaka proteiner inuti poren är ganska generisk och fungerar för många tillgängliga rekombinanta proteiner. Därför är det lätt att förse solid-state-nanoporen med önskad biologisk funktionalitet. Välj helt enkelt ett lämpligt protein, som specifikt känner igen målproteiner av intresse, och använd den för att sondera proteiner när de passerar. "
"Framtiden är fortfarande spännande, "Tampé säger, "eftersom naturen ligger långt före oss när det gäller selektivitet och specificitet. Därför behövs ytterligare förbättringar inom artificiella sensoriska system på molekylär nivå. Samarbetet mellan München- och Frankfurt -teamet utgör ett viktigt steg i biosensorisk och nanodiagnostisk teknik på nivån på enskilda molekyler. " Rant tillägger, "Det mesta av den senaste nanoporforskningen har riktats mot DNA -upptäckt och sekvensering. Jag hoppas att våra resultat visar att nanoporer också har potential att bli viktiga verktyg för proteinforskning. Och vem vet? Kanske får vi snart se introduktionen av protein nanopore sensorer som diagnostiska instrument för att upptäcka låga förekomst av sjukdomsmarkörer i patientprover. "