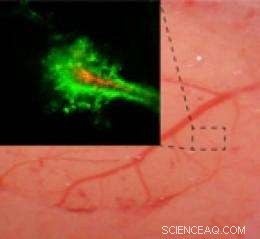
Realtidsavbildning av en gnagarhjärna visar att nanopartiklar belagda med polyetylenglykol (PEG) (grön) penetrerar längre in i hjärnan än partiklar utan PEG-beläggning (röd). Kredit:Elizabeth Nance, Graeme Woodworth, Kurt Sailor
Hjärnan är ett notoriskt svårt organ att behandla, men Johns Hopkins-forskare rapporterar att de är ett steg närmare att ha ett läkemedelsleveranssystem som är tillräckligt flexibelt för att övervinna några viktiga utmaningar som orsakas av hjärncancer och kanske andra sjukdomar som påverkar det organet.
I en rapport publicerad online den 29 augusti i Vetenskap translationell medicin , Johns Hopkins-teamet säger att deras bioingenjörer har designat nanopartiklar som säkert och förutsägbart kan infiltrera djupt in i hjärnan när de testas i gnagare och mänsklig vävnad.
"Vi är glada över att ha hittat ett sätt att förhindra att droginbäddade partiklar fastnar i sin omgivning så att de kan spridas när de väl är i hjärnan, säger Justin Hanes, Ph.D., Lewis J. Ort professor i oftalmologi, med sekundära utnämningar inom kemi- och biomolekylär teknik, Biomedicinsk forskning, onkologi, neurologisk kirurgi och miljöhälsovetenskap, och chef för Johns Hopkins Center for Nanomedicine.
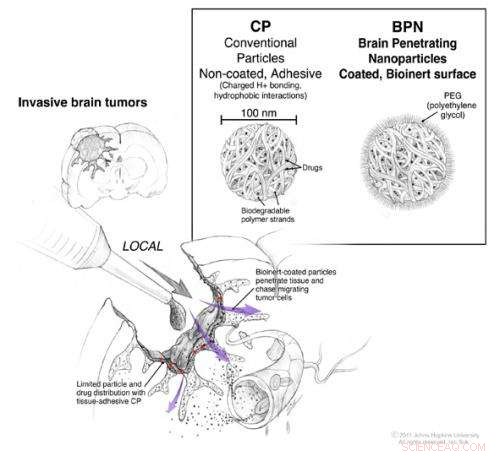
Under operation för att skära ut en hjärntumör, direkt tillgång till hjärnan och utrymmet mellan dess celler är möjligt. Konventionella nanopartiklar som bär kemoterapeutiska läkemedel kan appliceras under operationen, men de förblir i huvudsak på ytan där de appliceras (röda pilar). Nanopartiklar belagda med en tillräcklig mängd PEG har kapacitet att diffundera genom vävnaden (lila pilar) så att de kan migrera mot de enskilda tumörcellerna som har rymt från tumörmassan. Kredit:©2011. Johns Hopkins Institutionen för neurokirurgi. Alla rättigheter förbehållna. Ian Suk
Efter operation för att ta bort en hjärntumör, standardbehandlingsprotokoll inkluderar applicering av kemoterapi direkt på operationsstället för att döda alla kvarlämnade celler som inte kunde avlägsnas kirurgiskt. Hittills, denna metod för att förhindra återfall av tumörer är endast måttligt framgångsrik, till viss del, eftersom det är svårt att administrera en dos kemoterapi som är tillräckligt hög för att penetrera vävnaden tillräckligt för att vara effektiv och tillräckligt låg för att vara säker för patienten och frisk vävnad.
För att övervinna denna dosutmaning, ingenjörer designade nanopartiklar – ungefär en tusendel av diametern på ett människohår – som levererar läkemedlet i små, stadiga mängder över en tidsperiod. Konventionella nanopartiklar för läkemedelsleverans tillverkas genom att fånga in läkemedelsmolekyler tillsammans med mikroskopiska, strängliknande molekyler i en tät boll, som sakta bryts ner när den kommer i kontakt med vatten. Enligt Charles Eberhart, M.D., en Johns Hopkins-patolog och bidragsgivare till detta arbete, Dessa nanopartiklar har historiskt sett inte fungerat särskilt bra eftersom de fastnar på cellerna på appliceringsstället och tenderar att inte migrera djupare in i vävnaden.
Elizabeth Nance, en doktorand i kemisk och biomolekylär teknik vid Hopkins, och Hopkins neurokirurg Graeme Woodworth, M.D., misstänkte att läkemedelspenetrationen skulle kunna förbättras om nanopartiklar som levererar läkemedel interagerar minimalt med sin omgivning. Nance först belagde plastpärlor i nanostorlek av olika storlekar med en kliniskt testad molekyl som heter PEG, eller poly(etylenglykol), som hade visat sig av andra skydda nanopartiklar från kroppens försvarsmekanismer. Teamet resonerade att ett tätt lager av PEG också kan göra pärlorna mer hala.
Teamet injicerade sedan de belagda pärlorna i skivor av gnagare och mänsklig hjärnvävnad. De märkte först pärlorna med glödande taggar som gjorde det möjligt för dem att se pärlorna när de rörde sig genom vävnaden. Jämfört med icke-PEG-belagda pärlor, eller pärlor med en mindre tät PEG-beläggning, de fann att en tät beläggning av PEG gjorde att större pärlor kunde penetrera vävnaden, även de pärlor som var nästan dubbelt så stora som man tidigare trodde var maximalt möjliga för penetration i hjärnan. De testade sedan dessa pärlor i levande gnagarhjärnor och fann samma resultat.
Forskarna tog sedan biologiskt nedbrytbara nanopartiklar som bär kemoterapiläkemedlet paklitaxel och belade dem med PEG. Som förväntat, i råttas hjärnvävnad, nanopartiklar utan PEG-beläggningen rörde sig väldigt lite, medan PEG-täckta nanopartiklar fördelade sig ganska bra.
"Det är verkligen spännande att vi nu har partiklar som kan bära fem gånger mer drog, släpp det tre gånger så länge och tränga längre in i hjärnan än tidigare, " säger Nance. "Nästa steg är att se om vi kan bromsa tumörtillväxt eller återfall hos gnagare." Woodworth tillade att teamet "också vill optimera partiklarna och para ihop dem med läkemedel för att behandla andra hjärnsjukdomar, som multipel skleros, stroke, traumatisk hjärnskada, Alzheimers och Parkinsons." Ett annat mål för teamet är att kunna administrera sina nanopartiklar intravenöst, vilket är forskning de redan har påbörjat.