
Denna AFM-mikrografik av 2-D S-lager monterade på glimmer visar två olika vägar till kristallisering, en där domanerna är 2-3 nanometer högre (vita prickade cirklar) än den andra. Skillnader i de två höjdprofilerna, som mättes längs de horisontella prickade svarta linjerna, var resultatet av kinetisk fångst. Kredit:Molecular Foundry
(Phys.org)—Proteiner kan självmontera till ett brett utbud av välordnade strukturer som har en mångfald av egenskaper. Genom biomimicry – teknisk innovation inspirerad av naturen – hoppas människor kunna efterlikna proteiner och producera vår egen version av självmonterande molekyler. En nyckel för att uppnå detta är att förstå hur proteinveckning – en process som är avgörande för ett proteins form och funktion – utvidgas från enskilda proteiner till komplexa sammansättningar.
Forskare vid U.S. Department of Energy (DOE) Lawrence Berkeley National Laboratory (Berkeley Lab) har nu visat att ett koncept som är allmänt accepterat för att beskriva veckningen av ett enskilt individuellt protein också är tillämpligt på självmontering av flera proteiner. Deras resultat ger viktiga riktlinjer för framtida biomimikinsatser, speciellt för tillverkning av enheter och syntes i nanoskala.
"Vi har gjort de första direkta observationerna att konceptet med en viktratt med kinetiska energifällor för enskilda proteiner lika kan tillämpas på sammansättningen av ordnade proteinstrukturer, " säger Jim DeYoreo, en vetenskapsman vid Molecular Foundry, ett DOE nanovetenskapscenter vid Berkeley Lab, som ledde denna forskning tillsammans med Berkeley Lab-kemist Carolyn Bertozzi. "Våra resultat säger oss att ansträngningar för att upptäcka och kodifiera designreglerna för självmontering av komplexa molekylära system måste ta hänsyn till effekten av kinetiska fällor förknippade med konformationella transformationer."
DeYoreo och Bertozzi är motsvarande författarna till en tidning publicerad av Proceedings of the National Academy of Sciences (PNAS) som rapporterade denna forskning. Uppsatsen har titeln "Direkt observation av kinetiska fällor förknippade med strukturella transformationer som leder till flera vägar för S-skiktsmontering." Medförfattare till tidningen var Seong-Ho Shin, Sungwook Chung, Babak Sanii och Luis Comolli.
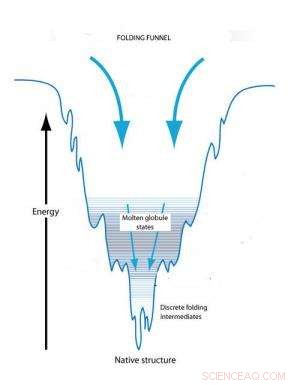
Vikningstrattkonceptet förklarar proteinveckning på basis av konformationsförändringar för att nå ett tillstånd av minimal fri energi. Ett ovikt protein börjar i ett tillstånd av hög fri och når sitt ursprungliga tillstånd med minimal energi. Kinetiska fällor längs vägen kan skapa övergående smälta kulor och vikning av mellanprodukter.
Proteiner är i huvudsak biomolekylära nanomaskiner som kan utföra många uppgifter på grund av deras förmåga att vika sig själva till en mängd former och former. När individuella proteiner självmonterar sig till ordnade strukturer antar den resulterande ensemblen ofta konformationer som är ganska distinkta från de individuella komponenterna.
"Till exempel, kollagenmatriser, som utgör de organiska byggnadsställningarna av ben och tänder, är konstruerade av trippelspiraler av individuella kollagenmonomerer, "DeYoreo säger. "Dessa spiraler kommer ytterligare att monteras till välorganiserade vridna fibriller som uppvisar en pseudohexagonal symmetri."
Vikningstrattkonceptet förklarar individuell proteinveckning på basis av konformationsförändringar för att nå ett tillstånd av minimal fri energi. Ett ovikt protein börjar i ett tillstånd av hög fri energi som gör dess konformation instabil. Initialt, det finns ett antal möjliga tredimensionella konformationer som skulle minska denna fria energi. Dock, när proteinet börjar vika sig, den fria energin börjar sjunka och antalet möjliga konformationer börjar minska som en tratts krympande bredd. Trattens botten nås när fri energi minimeras och det bara finns en tillgänglig konformation. När den fria energin sjunker, dock, det kan finnas kinetiska fällor längs vägen som kan stoppa veckningsprocessen och hålla proteinet i delvis vikta konformationer, kända som smälta kulor och vikningsmellanprodukter, under längre perioder. Så småningom kommer dessa fångade konformationstillstånd att omvandlas till en stabil konformation men formen och formen på den slutliga konformationen påverkas av de kinetiska fällorna.
"I en proteinvikningstratt, trattväggarna antas inte vara släta och de resulterande stötarna och dalarna definierar kinetiska fällor, " DeYoreo säger. "Denna fysiska bild av vikning har utforskats i detalj på en molekylnivå, men har inte övervägts för proteinsjälvmontering till utökade arkitekturer även om konformationstransformationer är en del av självmonteringsprocessen."
DeYoreo, Bertozzi och deras kollegor vidtog åtgärder för att korrigera denna kunskapsbrist genom att studera ytskiktsproteiner (S-lager) som självbildar samman till ett kristallint membran runt de enskilda cellerna av bakterier och Archaea. Detta yttre membran fungerar som den första kontaktpunkten mellan mikroben och dess miljö och är nyckeln till mikrobens förmåga att överleva. Använda in situ Atomic Force Microscopy (AFM), forskarna avbildade i realtid och på molekylär nivå kinetisk fångst under 2D-självmontering av S-lagerproteinstrukturer på glimmerytor.
"Vi observerade att självmontering av S-lagerproteiner spårar längs två olika vägar, en som leder direkt till lågenergifinalen, beordrat tillstånd, och den andra leder till en kinetisk fälla upptagen av ett långlivat övergående tillstånd som är mer oordnat, " DeYoreo säger. "Även om båda tillstånden är lättillgängliga under kristallkärnbildning, om systemet hamnar i högenergitillstånd, fly till finalen, lågenergitillstånd är starkt hämmat vid rumstemperatur. Detta visar vikten av kinetiska fällor för att bestämma vägen för S-skiktskristallisation och antyder att konceptet med vikningstrattar är lika giltigt för självmontering av utökade proteinstrukturer."