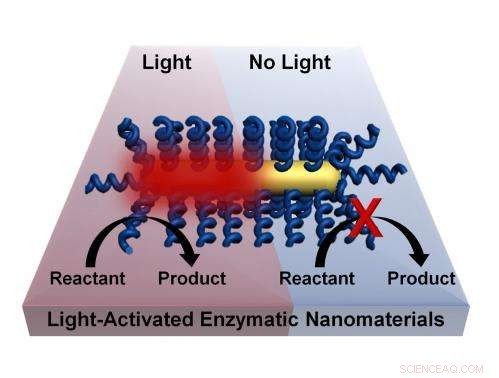
Kemiska processer kan aktiveras av ljus utan behov av bulkvärmning av ett material genom en process utvecklad av forskare vid Rice University. Tekniken går ut på att belägga nanorods med termofila enzymer som aktiveras vid höga temperaturer. Att tända den plasmoniska guldnanorod orsakar mycket lokal uppvärmning och aktiverar enzymet. Kredit:Lori Pretzer/Rice University
(Phys.org) – Sedan Edisons första glödlampa, värme har varit en mestadels oönskad biprodukt av ljus. Nu förvandlar forskare vid Rice University ljus till värme när det behövs, på nanoskala, för att utlösa biokemiska reaktioner på distans vid behov.
Metoden skapad av Rice labs av Michael Wong, Ramon Gonzalez och Naomi Halas och rapporterade idag i tidskriften American Chemical Society ACS Nano använder sig av material som härrör från unika mikrober – termofiler – som trivs vid höga temperaturer men stängs av vid rumstemperatur.
Rice-projektet som leds av postdoktor Matthew Blankschien och doktorand Lori Pretzer kombinerar enzymer från dessa varelser med plasmoniska guldnanopartiklar som värms upp när de utsätts för nära-infrarött ljus. Det aktiverar enzymerna, som sedan kan utföra sina uppgifter.
Detta tillåter effektivt kemiska processer att ske vid lägre temperaturer. Eftersom uppvärmning endast sker där det behövs - vid ytan av nanopartikeln, där det aktiverar enzymet – miljön förblir svalare.
Det tycker Blankschien är fascinerande.
"I grund och botten, vi får fördelarna med högtemperaturtillverkning utan att behöva en högtemperaturmiljö, sa Blankschien, som vann Peter och Ruth Nicholas postdoktorala stipendium för två år sedan för att arbeta med dessa idéer. "Utmaningen var att hålla den högre temperaturen vid nanopartikeln, där enzymet aktiveras, från att påverka miljön runt den."
Tekniken har stor potential för industriella processer som nu kräver värme eller drar nytta av fjärrtriggning med ljus.
"Konsekvenserna är ganska spännande, sa Wong, professor i kemi- och biomolekylär teknik och i kemi. "Inom den kemiska industrin, det finns alltid ett behov av bättre katalytiska material så att de kan köra reaktioner billigare, mer "grönt" och mer hållbart. Du bör inte köra igenom liter lösningsmedel för att göra ett milligram produkt, även om du råkar kunna sälja den för mycket pengar."
För industrin, enbart de potentiella energibesparingarna kan göra risprocessen värd att undersöka. "Här använder vi "gratis" energi, " sa Wong. "Istället för att behöva en stor panna för att producera ånga, du tänder en energieffektiv glödlampa, som en LED. Eller öppna ett fönster."
Partikeln i centrum av processen är en guld nanorod cirka 10 nanometer bred och 30 lång som värms upp när den träffas med nära-infrarött ljus från en laser. Stavarna har precis rätt storlek och form för att reagera på ljus vid cirka 800 nanometer. Ljuset exciterar ytplasmoner som krusar som vatten i en pool, i detta fall avger energi som värme.
Halas Rice lab är känt för att vara banbrytande för användningen av guld nanoskal (ett relaterat material) för att behandla cancer genom att rikta in sig på tumörer med partiklar som bulkvärms upp för att döda tumörer från insidan. Terapin är nu i mänskliga prövningar.
Den nya forskningen tar ett lite annorlunda grepp genom att värma nanopartiklar draperade med ett termofilt modellenzym, glukokinas, från Aeropyrum pernix. A. pernix är en mikrob som upptäcktes 1996 och frodas nära varma undervattensöppningar utanför Japans kust. Vid cirka 176 grader Fahrenheit, A. pernix bryter ner glukos, en process som är nödvändig för nästan allt levande. Enzymet kan värmas och kylas upprepade gånger.
I sina experiment, Blankschien och Pretzer klonade, renade och förändrade glukokinasenzymer så att de skulle fästa på guldnanopartiklarna. Enzym/nanopartikelkomplexen suspenderades sedan i en lösning och testades med avseende på glukosnedbrytning. När lösningen värmdes i bulk, de fann att komplexen blev mycket aktiva vid 176 grader, som förväntat.
Sedan inkapslades komplexen i en gelliknande pärla av kalciumalginat, som hjälper till att hålla värmen inne men är tillräckligt porös för att låta enzymer reagera med material runt omkring. Under bulkuppvärmning, enzymernas prestanda minskade dramatiskt eftersom pärlorna isolerade enzymerna för bra.
Men när inkapslade komplex belystes av kontinuerliga, nära infrarött laserljus, de fungerade avsevärt bättre än under bulkuppvärmning medan de lämnade lösningen nära rumstemperatur. Forskarna fann att komplexen var tillräckligt robusta för flera veckors återanvändning.
"Så långsökt det än låter, Jag tror att kemiföretag kommer att vara intresserade av idén att använda ljus för att tillverka kemikalier, " Sa Wong. "De är alltid intresserade av ny teknik som kan hjälpa till att göra kemiska produkter billigare."
Han ser andra möjliga användningsområden för det nya tillvägagångssättet vid produktion av bränslen från nedbrytning av biomassa som lignocellulosa; för läkemedelstillverkning på begäran – kanske från nanopartikelinfunderade tatueringar på kroppen; eller till och med för att sänka blodsockerkoncentrationerna som ett annat sätt att hantera diabetes.
"Att vi nu kan göra dessa partiklar är fantastiskt, "Wong sa. "Nästa spännande del är att tänka på hur vi kan distribuera dem."
Ryan Huschka, en medförfattare till tidningen, är en före detta Rice-student och nu biträdande professor i kemi vid Newman University. Halas är Stanley C. Moore-professor i elektro- och datateknik, professor i biomedicinsk teknik, kemi, fysik och astronomi och chef för Rice's Laboratory for Nanophotonics. Gonzales är docent i kemisk och biomolekylär teknik och även i bioteknik
Forskningen stöddes av Peter och Ruth Nicholas Postdoctoral Fellowship Program som administreras av Richard E. Smalley Institute for Nanoscale Science and Technology, Rice University Institute of Biosciences and Bioengineering Hamill Innovations Award Program, Rice University Faculty Initiatives Fund, Robert A. Welch Foundation, National Security Science and Engineering Faculty Fellowship, försvarets hotminskningsbyrå, Air Force Office of Scientific Research och National Science Foundation.