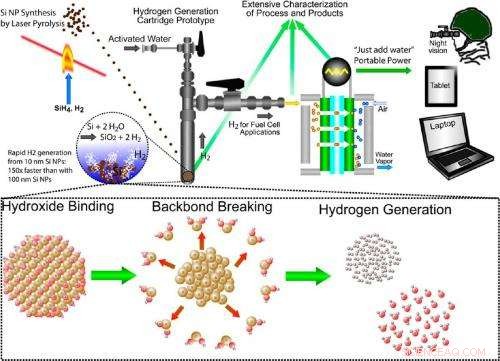
Illustration av det multidisciplinära tillvägagångssättet för att producera väte genom kiseloxidation. Tillvägagångssättet innebär att syntetisera kiselnanopartiklar, kisel-vattenreaktionen som genererar väte vid behov, och att använda vätgas i en bränslecell för bärbar kraft. Kredit:Folarin Erogbogbo, et al. ©2013 American Chemical Society
(Phys.org) – Även om forskare vet att när kisel blandas med vatten, väte bildas genom oxidation, ingen förväntade sig hur snabbt kiselnanopartiklar kunde utföra denna uppgift. Som en ny studie har visat, 10 nm kiselnanopartiklar kan generera väte 150 gånger snabbare än 100 nm kiselnanopartiklar, och 1, 000 gånger snabbare än bulkkisel. Upptäckten kan bana väg mot snabb "tillsätt bara vatten" vätegenereringsteknik för bärbara enheter utan behov av ljus, värme, eller el.
Forskarna, Folarin Erogbogbo vid University of Buffalo och medförfattare, har publicerat sin uppsats om att använda nanokisel för att generera väte i en ny utgåva av Nanobokstäver .
Om väte någonsin ska användas för att leverera energi för breda kommersiella tillämpningar, ett av kraven är att hitta en snabb, billigt sätt att producera väte. En av de vanligaste teknikerna för väteproduktion är att dela vatten i väte och syre. Det finns flera sätt att dela vatten, till exempel med en elektrisk ström (elektrolys), värme, solljus, eller ett ämne som kemiskt reagerar med vatten. Sådana ämnen inkluderar aluminium, zink, och kisel.
Som forskarna förklarade, kisel-vattenoxidationsreaktioner har hittills varit långsamma och inte konkurrenskraftiga med andra vattenklyvningstekniker. Dock, kisel har några teoretiska fördelar, som att vara riklig, vara lätt att transportera, och har en hög energitäthet. Ytterligare, vid oxidation med vatten, kisel kan teoretiskt frigöra två mol väte per mol kisel, eller 14 % av sin egen massa i väte.
Av dessa anledningar, forskarna bestämde sig för att titta närmare på kisel, speciellt kiselnanopartiklar, som inte tidigare har studerats för vätegenerering. Eftersom kiselnanopartiklar har en större yta än större partiklar eller bulkkisel, man kan förvänta sig att nanopartiklarna kan generera väte snabbare än de större bitarna av kisel.
Men de förbättringar som forskarna upptäckte med kiselnanopartiklar överträffade vida deras förväntningar. Reaktionen av 10-nm kiselpartiklar med vatten gav totalt 2,58 mol väte per mol kisel (även överträffande teoretiska förväntningar), tar 5 sekunder att producera 1 mmol väte. I jämförelse, reaktionen med 100 nm kiselpartiklar gav totalt 1,25 mol väte per mol kisel, tar 811 sekunder att producera varje mmol väte. För bulkkisel, total produktion var endast 1,03 mol väte per mol kisel, det tar hela 12,5 timmar att producera varje mmol väte. För en prisjämförelse, 10 nm kisel genererade väte 150 gånger snabbare än 100 nm kisel och 1, 000 gånger snabbare än bulkkisel.
"Jag tror att den största betydelsen av detta arbete är demonstrationen att kisel kan reagera med vatten tillräckligt snabbt för att vara praktiskt användbar för vätgasgenerering på begäran, "medförfattare Mark Swihart, Professor i kemi- och biologisk teknik vid University of Buffalo, berättade Phys.org . "Detta resultat var både oväntat och av potentiell praktisk betydelse. Även om jag inte tror att oxidation av kiselnanopartiklar kommer att bli en genomförbar metod för storskalig vätegenerering snart, denna process kan vara ganska intressant för småskaliga bärbara applikationer där vatten är tillgängligt."

En jämförelse av vätegenereringshastigheter för olika former av kisel. Maximala priser finns i den vänstra kolumnen med bilder av proverna på dem. Genomsnittliga priser finns i den högra kolumnen. Den röda linjen indikerar den maximala rapporterade hastigheten för väte som genereras från aluminium. Kredit:Folarin Erogbogbo, et al. ©2013 American Chemical Society
Förutom att producera väte snabbare än större kiselbitar, 10-nm-kislet producerar också väte betydligt snabbare än nanopartiklar av aluminium och zink. Som Swihart förklarade, förklaringen till denna ojämlikhet skiljer sig för de två materialen.
"Jämfört med aluminium, kisel reagerar snabbare eftersom aluminium bildar en tätare och mer robust oxid (Al 2 O 3 ) på dess yta, vilket begränsar reaktionen, " sa han. "I närvaro av en bas som KOH [kaliumhydroxid], kisel producerar mestadels löslig kiselsyra (Si(OH) 4 ). Jämfört med zink, kisel är helt enkelt mer reaktivt, speciellt vid rumstemperatur."
Även om den större ytan av 10-nm kisel jämfört med större kiselbitar bidrar till dess snabba väteproduktionshastighet, ytan ensam kan inte förklara den enorma hastighetsökningen som forskarna observerade. Ytan för 10-nm kisel är 204 m 2 /g, cirka 6 gånger större än ytan av 100 nm kisel, vilket är 32 m 2 /g.
För att förstå vad som orsakar den mycket större ökningen av väteproduktionshastigheten, forskarna genomförde experiment under kiseletsningsprocessen. De fann att, för 10-nm-partiklarna, etsning innebär att ett lika stort antal gitterplan avlägsnas i varje riktning (isotropisk etsning). I kontrast, för 100-nm partiklar och mikropartiklar, ojämnt antal gitterplan avlägsnas i varje riktning (anisotropisk etsning).
Forskarna tillskriver denna etsningsskillnad till de olika geometrierna hos kristaller av olika storlek. Som ett resultat av denna skillnad, de större partiklarna antar icke-sfäriska former som exponerar mindre reaktiva ytor jämfört med de mindre partiklarna, som förblir nästan sfäriska, exponerar alla kristallfasetter för reaktion. Större partiklar utvecklar också tjockare lager av oxiderade kiselbiprodukter genom vilka vatten måste diffundera. Båda dessa faktorer begränsar reaktionshastigheten på större partiklar.
För att bekräfta att 10-nm kisel-vatten-reaktionen genererar väte utan biprodukter som kan störa tillämpningar, forskarna använde det kiselgenererade vätet för att driva en bränslecell. Bränslecellen fungerade mycket bra, producerar mer ström och spänning än den teoretiska mängden rent väte, vilket beror på att 10-nm-partiklarna genererade mer väte än de teoretiska 14 viktprocenten.
Forskarna hoppas att denna överraskande förmåga hos kiselnanopartiklar att snabbt dela vatten och generera väte kan leda till utvecklingen av en väte-on-demand-teknik som kan göra det möjligt att använda bränsleceller i bärbara enheter. Denna teknik skulle kräva en storskalig, energieffektiv metod för produktion av nanopartiklar av kisel, men kan ha vissa fördelar jämfört med andra tekniker för vätegenerering.
"Den viktigaste fördelen med kiseloxidation för vätegenerering är dess enkelhet, " sade Swihart. "Med detta tillvägagångssätt, väte produceras snabbt, vid rumstemperatur, och utan behov av någon extern energikälla. Den energi som behövs för vätegenerering lagras effektivt i kislet. All energitillförsel som krävs för att producera kisel kan tillhandahållas på en central plats, och kislet kan sedan användas i bärbara applikationer.
"Den viktigaste nackdelen med kiseloxidation är dess relativa ineffektivitet. Den energiinsats som krävs för att skapa kiselnanopartiklarna är mycket större än den energi som är tillgänglig från det väte som slutligen produceras. För storskaliga tillämpningar, detta skulle vara ett problem. För bärbara applikationer, det är det inte. Till exempel, kostnaden för el som levereras av ett vanligt hushållsbatteri kan lätt vara 10 till 100 gånger högre än kostnaden för el från ett kraftverk, men batterier spelar fortfarande en viktig roll i våra liv."
I framtiden, forskarna planerar att ytterligare öka vätegenereringskapaciteten för kiseloxidation genom att experimentera med olika blandningar.
"En riktning som vi för närvarande följer är användningen av blandningar av kiselnanopartiklar med metallhydrider, som också reagerar med vatten för att producera väte, "Sade Swihart. "Föreningar som litiumhydrid och natriumhydrid reagerar med vatten för att producera basen (LiOH eller NaOH) som behövs för att katalysera kiseloxidationen. Dock, de kan reagera för snabbt med vatten (explosivt) och är inte stabila i luft. Att blanda dem med kiselnanopartiklar eller belägga dem med kiselnanopartiklar kan tjäna till att både mildra deras reaktivitet och öka systemets vätegenereringskapacitet genom att ersätta den tillsatta basen (t.ex. KOH i den publicerade tidningen) med ett material som också genererar väte."
Copyright 2013 Phys.org
Alla rättigheter förbehållna. Detta material får inte publiceras, utsända, omskrivs eller omdistribueras helt eller delvis utan uttryckligt skriftligt tillstånd från Phys.org.