Forskare som arbetar vid Institut Laue-Langevin har visat att laddningen av guldnanopartiklar, identifieras av stora läkemedelsföretag som framtidens läkemedelsleverantör för behandling av cancer, påverkar hur de interagerar med vår cells skyddande yttervägg. Dessa viktiga insikter, publicerad i Langmuir , ge ett första steg i den effektiva utformningen av säkra nanopartiklar för biomedicinska tillämpningar och metoder och procedurer för säker hantering i en mängd andra konsumentprodukter.
Den växande användningen av nanopartiklar, små flingor av material, 1 miljonedel så stor som ett sandkorn, i ett brett utbud av kommersiella produkter, som kläder, matförvaringsbehållare, läkemedel, kosmetika, däck, elektronik och optiska enheter, är kontroversiell. Vanliga nanopartiklar, som guld, silver och koppar, lätt penetrera organiska membran, (cellväggar, ...) skapa potentiellt betydande effekter på människors hälsa och miljön. Dock, det finns ett område där deras toxicitet kan vara användbar och till och med livräddande.
En stor utmaning inom modern medicin är att hitta leveransmedel som kan rikta in och tränga igenom celler för att transportera läkemedel direkt inuti den infekterade vävnaden. Sökandet efter rätt fordon har lett till ett nytt forskningsområde, 'nanomedicin', där nanopartiklar kan programmeras för att rikta in cancerceller till exempel, minska eller till och med eliminera behovet av operation.
Av alla nanopartiklar som är tillgängliga för medicinsk vetenskap, en i synnerhet har blivit ett fokus för forskning bland stora läkemedelsföretag - guld. AstraZeneca tillkännagav förra året ett nytt forskningsprojekt för att titta på en ny nanomedicin, CYT-6091, baserat på guldnanopartiklar.
Guldnanopartiklar gör särskilt bra leveransfordon eftersom:
Dock, för närvarande förstår vi inte i detalj vilka interaktionsmekanismer mellan nanopartiklar och cellens yttre försvar - cellmembranet. Utan detta är det omöjligt att avgöra hur farliga de är och om deras förmåga att penetrera och förstöra celler någonsin kan utnyttjas för goda ändamål, som i kampen mot cancer.
En sak som är känd är att det finns en komplex uppsättning parametrar som påverkar denna interaktion, inklusive nanopartikelns form, storlek, sammansättning och laddning. Men en systematisk studie som visar hur interaktionen beror på dessa parametrar på molekylär nivå har hittills saknats.
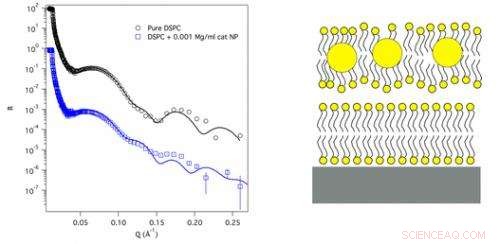
För att börja ta itu med detta, en forskargrupp från Institut Laue-Langevin (ILL), University of Illinois och Australian Nuclear Science and Technology Organization använde ILL:s neutroner och världsledande neutronspridningsinstrument för att undersöka, på molekylär nivå, de fysiska förändringar som våra cellväggar genomgår när de kommer i kontakt med guldnanopartiklar av olika laddning.
Guldnanopartiklar med 2 nm diameter hade antingen katjoniska (positivt laddade) eller anjoniska (negativt laddade) grupper tillsatta till deras yta. För att efterlikna cellmembranet, forskargruppen använde två dubbla lager av fettlipidmolekyler som hölls 20-30 Å ovanpå varandra som tillsammans producerade de dynamiska egenskaperna som ses i cellmembranen. Forskarna tillämpade sedan neutronreflektometri -tekniker vid ILL för att exakt modellera nanopartikel -cellmembraninteraktionen på en bråkdel av en nanometer skala.
Vad de fann var att nanopartikelns ytladdning verkligen spelar en viktig roll för att bestämma deras interaktion med våra cellmembran. Katjoniska nanopartiklar passerar rakt genom lipidmembranet och bäddar in sig djupt i det flytande dubbelskiktet, destabilisera hela membranstrukturen tillräckligt för att fullständigt förstöra cellen vid högre koncentrationer. I kontrast, anjoniska nanopartiklar penetrerar inte alls lipidmembranet. Snarare, vid givna koncentrationer hindrar de membranets sönderdelning och hjälper det att klara den slags extrema förhållanden, såsom förhöjt pH, som normalt skulle destabilisera det avsevärt.