Med storleksbaserad kromatografi, en hexagonalt ordnad uppsättning guldnanopartiklar tillverkas på ett hybrid levande cellunderhållet membran. Membrankomponenter rör sig fritt genom matrisen förutsatt att de inte överskrider dess fysiska dimensioner. Detta avslöjar organisatoriska aspekter av membranmiljön som inte kan observeras av andra tekniker.
(Phys.org) - Med hjälp av nanodot -teknik, Berkeley Lab-forskare har visat den första storleksbaserade formen av kromatografi som kan användas för att studera membran i levande celler. Detta unika fysiska tillvägagångssätt för sonderande cellulära membranstrukturer kan avslöja information som är kritisk för om en cell lever eller dör, förblir normal eller blir cancerös, som inte kan erhållas genom konventionell mikroskopi.
"Vi har utvecklat membraninbäddade nanodot-array-plattformar som ger ett fysiskt sätt att både sonda och manipulera membranaggregat, inklusive signaleringskluster, medan de fungerar i membranet i en levande cell, säger Jay Groves, en kemist med Berkeley Labs division för fysiska biovetenskaper, som ledde denna forskning.
Lundar, som också är professor vid University of California (UC) Berkeleys kemiavdelning, och en Howard Hughes Medical Institute (HHMI) utredare, är en erkänd ledare för att utveckla tekniker för att studera effekterna av rumsmönster på levande celler. De levande cellstödda syntetmembranen som han och hans grupp har utvecklat är konstruerade av lipider och monterade på ett substrat av fast kiseldioxid. Dessa membran används för att bestämma hur levande celler inte bara interagerar med sin miljö genom kemiska signaler utan också genom fysisk kraft och rumsmönster.
"Vi kallar vårt tillvägagångssätt för den rumsliga mutationsstrategin eftersom molekyler i en cell kan rumsligt omarrangeras utan att cellen förändras på något annat sätt, "Groves säger." Våra levande cellstödda membran tillhandahåller ett hybridgränssnitt bestående av mobila och orörliga komponenter med kontrollerad geometri som gör att vi kan använda solid-state nanoteknik för att manipulera och kontrollera molekylära system inuti levande celler. "

Jay Groves. Upphovsman:Roy Kaltschmidt
Medan Groves och andras arbete under de senaste åren har visat vikten av protein- och lipidrumslig organisation inom cellulära membran, detaljer om hur rumslig organisation är knuten till funktion är knappa, främst på grund av begränsningarna för optisk mikroskopi vid längdskalor under 250 nanometer diffraktionsgränsen. Den storleksbaserade kromatografitekniken som utvecklats av Groves och hans grupp gör det möjligt för dem att sondera supramolekylära strukturer i ett cellmembran vid de nödvändiga nanometerlängden.
"Vi har nu ett sätt att översätta nanostorlekar som närmar sig molekylära dimensioner till geometriska begränsningar för molekylernas rörelse inuti en levande cell, Säger Groves.
För deras storleksbaserade kromatografiteknik, avståndet mellan proteiner och andra cellulära molekyler styrs av en sexkantig eller bikakemängd av guldnanopartiklar som tillverkas i membranet. Avståndet mellan nanopartiklar i varje array kan kontrolleras, med tillgängliga storlekar från 30 till nästan 200 nanometer.
"Enskilda membrankomponenter rör sig fritt genom hela gruppen, men rörelse av större sammansättningar hindras om de överskrider matrisens fysiska dimensioner, Säger Groves.
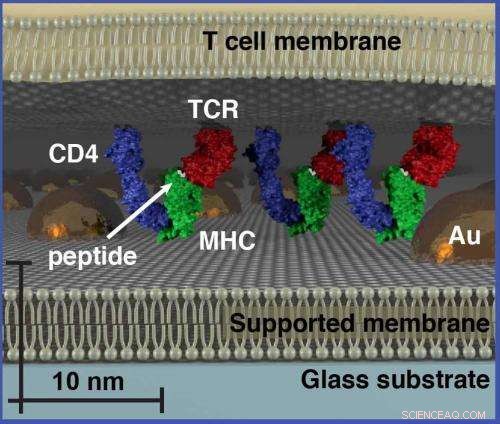
Groves och hans kollegor testade sin storleksbaserade kromatografiteknik på T-cellreceptor (TCR) mikrokluster i T-cellmembran, som är den funktionella modulen för antigenigenkänning av T -celler (lymfocyter från thymus) i kroppens immunsystem. Dessa TCR -signaleringskluster upptar en storleksregim som sträcker sig från tiotals till några hundra nanometer, som vanligtvis ligger under diffraktionsgränsen för konventionell optisk mikroskopi. Storleksbaserad kromatografi användes för att undersöka de fysikaliska egenskaperna hos TCR-signaleringskluster som en funktion av antigens densitet. Resultaten avslöjade att TCR -signalkluster är tydligt beroende av mängden antigen som cellen möter.
"Det här är något vi inte visste tidigare om TCR -mikroclustersignaleringssystemet, som har studerats väl med konventionell optisk mikroskopi, "Groves säger." Det är en bevisning av principen som representerar ytterligare ett steg i riktningen att koppla samman levande celler med syntetiska material för att uppnå molekylär nivåkontroll av cellen. "