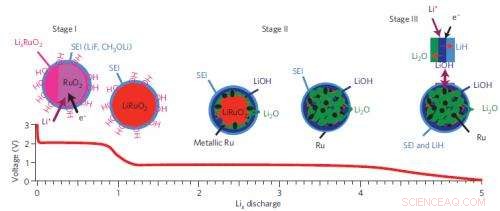
En sammanfattning av reaktionsvägen i tre steg i ruteniumoxid-litiumbatterisystemet.
Litium (Li) jonbatterier driver nästan alla bärbara elektroniska enheter som vi använder varje dag, inklusive smarta telefoner, kameror, leksaker, och även elbilar. Forskare över hela världen arbetar med att hitta material som leder till säkra, billig, långvarig, och kraftfulla Li-ion-batterier.
Arbetar på olika U.S. Department of Energy ljuskällanläggningar och vid Cambridge och Stony Brook universitet, en grupp forskare studerade nyligen en klass av Li-ion-batterielektroder som har mycket större kapacitet än de material som används i dagens batterier. Forskarna ville avgöra varför dessa material ofta kan lagra mer laddning än teorin förutspår.
Författarna valde ruteniumoxid (RuO2) som ett modellsystem för att studera dessa så kallade "omvandlingsmaterial, "namnges eftersom de genomgår stora strukturförändringar när de reagerar med litiumjoner, reversibelt bildande metallnanopartiklar och salter (här Ru och Li2O). Dessa reaktioner skiljer sig mycket från de som förekommer i konventionella elektroder, som lagrar laddning genom att tillåta Li -joner att bo i utrymmen inom kristallgitteret.
"Vår undersökning identifierade källan till den extra kapacitet som hittades för RuO2, och har också gett ett protokoll för att studera det 'passiveringsskikt' som bildas på batterielektroder, som skyddar elektrolyten från att genomgå ytterligare sönderdelningsreaktioner i efterföljande laddningsurladdningscykler, "sa studiens motsvarande forskare, Clare Gray, professor i kemiavdelningarna vid universiteten i Cambridge och Stony Brook. "Att förstå strukturerna för dessa passiveringsskikt är nyckeln till att skapa batterier som räcker tillräckligt länge för användning i applikationer som transport och lagring av elnät."
Vid Brookhaven National Laboratory National Synchrotron Light Source, laget studerade sina prover med hjälp av röntgenabsorption nära kanten struktur (XANES) och förlängd röntgenabsorberingsfinstruktur (EXAFS). Vid Advanced Photon Source vid Argonne National Laboratory, de använde ytterligare två tekniker, högupplöst röntgendiffraktion (XRD) och spridningspars distribution (PDF) analys, för att extrahera information om de elektroniska och lång-/kortdistansstrukturförändringarna av RuO2-elektroden i realtid när batteriet laddades ur och laddades. Med hjälp av dessa metoder, laget visade att RuO2 reducerades till Ru nanopartiklar och Li2O genom bildandet av mellanliggande faser, LixRuO2.
Eftersom detta inte förklarade källan till den extra avgiftslagringsmekanismen, gruppen använde en annan teknik, högupplöst kärnmagnetisk resonans (NMR) i fast tillstånd. Denna metod innebär att ett prov utsätts för ett magnetfält och mäts svaret på kärnorna i provet. Det kan ge specifik information om de kemiska kompositionerna och lokala strukturer, och är särskilt användbart för att studera föreningar som endast innehåller "lätta" element, såsom väte (H), Li, och syre (O), som är svåra att upptäcka med XRD. NMR -data visade att den största bidragsgivaren till kapaciteten är bildandet av LiOH, som reversibelt konverterar till Li2O och LiH. Mindre bidrag till kapaciteten kommer från Li -lagring på Ru nanopartikelytorna, bilda en LixRu -legering, och sönderdelningen av elektrolyten. Den senare, dock, orsakar slutligen kapaciteten att minska och kommer att resultera i att batteriet dör efter flera laddningscykler.